| 제품명 |
|
|||
|---|---|---|---|---|
| 성분 / 함량 | 동일성분 의약품 | |||
| 첨가제 | ||||
| 도핑금지 약물정보 |
경기기간중 : 허용 경기기간외 : 허용
상세정보 확인
※ 상세정보는 반드시 한국도핑방지위원회 홈페이지를 통해 확인해주세요. |
|||
| 전문 / 일반 | 단일 / 복합 | |||
| 제조 / 수입사 | ||||
| 제형 | 투여경로 | |||
| 성상 | ||||
| 허가일 |
|
|||
| 재심사 | ||||
| 대조 / 생동 | ||||
| 급여정보 | ||||
| ATC 코드 | ||||
| 식약처 분류 | ||||
| KPIC 약효분류 |
|
|||
| 대한약사저널 |
약대약
DTaP vs Tdap/Td(디프테리아, 파상풍, 백일해 백신), 김형은 약사, 2020-08-31
|
|||
| 제품설명서 | 보 기 ( 2017-10-10 게시 ) | |||
| 의약품안전성 정보(DUR) |
||||
| 포장단위 (식약처 기준) |
||||
| 저장방법 | ||||
사용자GNB바
컨텐츠
의약품 상세정보
허가정보 ∙ 복약정보
효능 · 효과
만 10세 이상의 청소년 및 성인에서 디프테리아, 파상풍 및 백일해의 예방
용법 · 용량
영 ▪ 유아 시기에 소아용 디프테리아 ◦파상풍 톡소이드 및 정제백일해 혼합백신(DTaP) 권장 접종 일정을 일정대로 모두 마친 만 10세 이상의 청소년 및 성인을 대상으로 추가접종하며 10년 후 재접종할 수 있다.
1회 투여용량(0.5mL)을 삼각근에 근육주사하며 혈관 내 직접 투여하지 않는다.
사용전 충분히 흔들어서 사용한다.
파상풍 톡소이드가 필요한 자가 파상풍이 발생하기 쉬운 상처(예: 먼지, 분변, 흙 및 침으로 오염된 상처; 관통상 등)를 입은 경우, 5년 이내 파상풍 톡소이드에 백신 접종력이 없는 경우 본 백신을 성인용 디프테리아‑파상풍 백신 대용으로 사용할 수 있다.
(주의: 본 백신은 영 ◦ 유아에 대한 기초접종에 사용할 수 없다. 즉 영 ◦ 유아 시기의 표준예방접종은 소아용 DTaP를 접종하여야 한다.)
사용상의 주의사항
1. 다음 환자에는 투여하지 말 것
2) 이전에 백일해 성분을 함유하는 백신 접종 후 7일 이내에 병인이 알려지지 않은 뇌병증을 경험한 자. 이 때는 백일해 백신 접종을 중지하고, 디프테리아‑파상풍 백신을 사용하여야 한다.
3) 이전에 디프테리아 및/또는 파상풍 접종 후, 일시적인 혈소판 감소증 또는 신경학적 합병증을 경험한 자
2. 다음 환자에는 신중히 투여할 것
1) 다른 백신처럼, 급성중증열성 질환자의 경우 접종을 연기해야 한다. 그러나, 경미한 감염은 접종 금기가 아니다.
2) 혈소판 감소증 혹은 혈액 응고장애가 있는 자에게는 근육주사 후 출혈이 발생할 수 있으므로 주의하여야 한다. 주사부위를 문지르지 않고 2분 이상 눌러준다.
3) 백일해 접종 후, 백일해 접종과 관련될 수 있는 아래 반응 중 하나라도 발생했다면, 백일해 성분을 함유하는 백신을 투여할지 여부를 신중히 고려해야 한다.
‑ 확인 가능한 다른 원인에 의한 것이 아닌, 백신접종 후 48시간 이내에 발생하는 40℃ 이상의 열
‑ 백신 접종 후 48시간 이내의 허탈 또는 쇼크같은 상태(근육긴장저하‑무반사)
‑ 백신 접종 후 48시간 이내에 발생하는 3시간 이상 계속되는 지속적이고 달랠 수 없는 울음
‑ 백신 접종 후 3일 이내에 발생하는 열을 동반한 또는 동반하지 않은 경련
이런 경우에도, 백일해 유행 시기와 같이 접종에 의한 잠재적인 유익성이 발생 가능한 위험성을 상회하는 상황에서는 접종을 고려할 수 있다.
4) DTP를 접종한 후, 경련의 병력이 있거나 경련이나 이상사례에 대한 가족력이 있는 것은 접종금기사항은 아니나 신중 투여를 요한다.
5) 이전에 파상풍톡소이드를 포함하는 백신 접종 후 6주 이내에 길랑‑바레 증후군이 나타났을 경우, 이 백신이나 파상풍 톡소이드를 함유하는 백신의 접종 여부는 위험성과 유익성을 고려하여 결정되어야 한다.
6) 진행성 신경계 질환, 조절 불가능한 뇌전증 또는 진행성 뇌병증 환자 또는 불안정한 신경상태(예, 뇌혈관발적 및 급성 뇌병증)의 환자인 경우 본 백신이나 백일해 항원을 함유하는 백신의 접종 여부를 위험성과 유익성을 고려하여 신중히 결정되어야 한다.
7) 이전에 파상풍 톡소이드 함유 백신을 접종 받은 후, 아루투스 타입의 과민 반응(Arthus‑Type Hypersensitivity)을 경험한 자는 보통 혈중 파상풍 항독소 수치가 높다. 이전에 파상풍 톡소이드 함유 백신을 마지막으로 투여한 후 최소 10년 이내에는 본 백신이나 파상풍 톡소이드를 함유하는 다른 백신을 접종받아서는 안된다.
3. 약물이상반응
1) 임상시험
약 3,000명의 피험자가 임상시험에서 이 백신 1회 용량을 투여받았다.
백신 접종 후 가장 빈번하게 일어난 반응은 주사부위 국소반응(통증, 발적 및 부종)으로, 각 임상시험에서 피험자의 50~92%에서 관찰되었다. 이들 반응은 백신 접종 후 48시간 이내에 나타났으며, 모든 증상은 후유증 없이 소실되었다.
아래의 안전성 프로파일은 1,931명의 소아(10세 이상), 청소년 및 성인에게 이 백신을 투여한 임상시험자료에 근거한다.
보고된 약물이상반응은 다음 빈도에 따라 나열하였다.
매우 흔함 (≧10%)
흔함 (≧1% 및 ˂10%)
흔하지 않음 (≧0.1% 및 ˂1%)
드물게 (≧0.01% 및 ˂0.1%)
매우 드물게 (˂0.01%)
◦ 전신 이상 및 투여부위 증상:
‑ 매우 흔함: 주사부위 반응(통증, 발적 및 부종 포함), 피로, 불쾌감
‑ 흔함: 발열(≧37.5℃), 주사부위 반응(주사부위 뭉침 및 주사부위의 무균성 농양)
‑ 흔하지 않음: 발열(>39.0℃), 인플루엔자 유사 질환, 통증
◦ 신경계 이상
‑ 매우 흔함: 두통
‑ 흔함: 현기증
‑ 흔하지 않음: 실신
◦ 위장관계 이상
‑ 흔함: 구역, 위장관계 이상
‑ 흔하지 않음: 설사, 구토
◦ 근골격근 및 결합조직 이상
‑ 흔하지 않음: 관절통, 근육통, 관절 경직, 근골격 경직
◦ 피부 및 피하조직 이상
‑ 흔하지 않음: 다한증, 소양증, 발진
◦ 혈액 및 림프계 이상
‑ 흔하지 않음: 림프절병증
◦ 감염
‑ 흔하지 않음: 상기도감염, 인두염
◦ 호흡기, 흉부 및 종격 이상
‑ 흔하지 않음: 기침
2) 해외 시판 후 조사
◦ 혈액 및 림프계 이상
‑ 드물게: 혈관부종
◦ 면역계 이상
‑ 매우 드물게: 아나필락시 반응 및 아나필락시 양반응을 포함하는 알레르기 반응
◦ 신경계 이상
‑ 드물게: 경련(발열 동반 또는 발열 동반하지 않음)
◦ 피부 및 피하조직 이상
‑ 드물게: 두드러기
◦ 전신 이상 및 주사부위 반응
‑ 드물게: 투여된 사지의 광범위한 부종, 무력증
추가로 첨가제 구성이 다른 미국의 부스트릭스에 대한 임상시험 결과에 따른 이상사례는 다음과 같다.
10~18세의 미국 청소년을 대상으로 한 임상시험에서 3,080명은 이 백신을, 1,034명은 Td백신을 1회 투여받았다. 그리고 미국에서, 19~64세의 성인 2,284 명을 대상으로 이 백신의 안전성을 미국에서 허가된 다른 Tdap 백신과 비교 평가하는 임상시험이 실시되었다.
◦ 미국 청소년 대상 안전성 시험에서의 명시된 이상사례
표 1은 총 접종 코호트(total vaccinated cohort)에서 이 백신 또는 Td 백신 접종 15일 이내에 발생한 명시된 국소이상사례 및 전신이상사례를 보여준다.
이 백신 투여군 중 4.6%, Td 백신 접종군 중 4.0%가 3등급의 접종부위 통증(건드리지 않아도 아픔 및/또는 일상생활 방해)을 보고하였다. 3등급의 통증 관련 발생율 차이는 사전에 정의된 비열등성에 대한 임상 범위 내에 속하였다.
표 1. 10~18세 청소년을 대상으로, 접종 후 15*일 이내의 명시된 국소이상사례 또는 전신이상사례 발생율(총 접종 코호트)
|
|
이 백신 (N=3,032) % |
Td (N=1,013) % |
|
국소 | ||
|
통증, 모든1) 통증, 2 또는 3등급1) 통증, 3등급2) |
75.3 51.2 4.6 |
71.7 42.5 4.0 |
|
발적, 모든 발적, > 20mm 발적, ≥ 50mm |
22.5 4.1 1.7 |
19.8 3.9 1.6 |
|
부종, 모든 부종, > 20mm 부종, ≥ 50mm |
21.1 5.3 2.5 |
20.1 4.9 3.2 |
|
팔둘레 증가, >5 mm3) 팔둘레 증가, >20 mm3) 팔둘레 증가, >40 mm3) |
28.3 2.0 0.5 |
29.5 2.2 0.3 |
|
전신 |
|
|
|
발열, ≥37.5℃4) 발열, > 38℃4) 발열, > 39℃4) |
13.5 5.0 1.4 |
13.1 4.7 1.0 |
|
두통, 모든 두통, 2 또는 3등급1) 두통, 3등급 |
43.1 15.7 3.7 |
41.5 12.7 2.7 |
|
피로, 모든 피로, 2 또는 3등급 피로, 3등급 |
37.0 14.4 3.7 |
36.7 12.9 3.2 |
|
위장관계 증상, 모든5) 위장관계 증상, 2 또는 3등급5) 위장관계 증상, 3등급5) |
26.0 9.8 3.0 |
25.8 9.7 3.2 |
2등급=국소: 팔을 움직일 때 아픔; 전신: 일상생활에 영향을 줌
3등급=국소: 건드리지 않아도 아픔 및/또는 일상생활 방해; 전신: 일상생활 방해
*: 접종 당일 및 접종 14일 후
1): Td백신과 비교하였을 때, 이 백신에서 통계적으로 유의하게 더 높음(p˂0.05)
2): 3등급 접종부위 통증 관련, Td백신과 비교하였을 때, 이 백신은 열등하지 않음
3): 접종받은 팔의 중간 상완
4): 구강 또는 액와 체온
5): 구역, 구토, 설사 및/또는 복통을 포함하는 위장관계 증상◦ 미국 청소년 대상 안전성 시험에서의 명시되지 않은 이상사례
접종 후 31일내에 보고된 명시되지 않은 이상사례의 발생율은 두 군에서 유사하였다(이 백신 투여군: 25.4%, Td 투여군: 24.5%).
◦ 미국 성인 대상 안전성 시험에서의 명시된 이상사례
표 2는 총 접종 코호트(total vaccinated cohort)에서 이 백신 또는 다른 Tdap 백신 접종 15일 이내에 발생한 명시된 국소이상사례 및 전신이상사례를 보여준다.
표 2 성인을 대상으로, 접종 후 15*일 이내의 명시된 국소이상사례 또는 전신이상사례 발생율(총 접종 코호트)
|
|
이 백신 (N=1,480) % |
Tdap (N=741) % |
|
국소 | ||
|
통증, 모든 통증, 2 또는 3등급 통증, 3등급 |
61.0 35.1 1.6 |
69.2 44.4 2.3 |
|
발적, 모든 발적, > 20mm 발적, ≥ 50mm |
21.1 4.0 1.6 |
27.1 6.2 2.3 |
|
부종, 모든 부종, > 20mm 부종, ≥ 50mm |
17.6 3.9 1.4 |
25.6 6.3 2.8 |
|
전신 |
||
|
발열, ≥ 37.5℃1) 발열, > 38℃1) 발열, > 39℃1) |
5.5 1.0 0.1 |
8.0 1.5 0.4 |
|
두통, 모든 두통, 2 또는 3등급 두통, 3등급 |
30.1 11.1 2.2 |
31.0 10.5 1.5 |
|
피로, 모든 피로, 2 또는 3등급 피로, 3등급 |
28.1 9.1 2.5 |
28.9 9.4 1.2 |
|
위장관계 증상, 모든2) 위장관계 증상, 2 또는 3등급2) 위장관계 증상, 3등급2) |
15.9 4.3 1.2 |
17.5 5.7 1.3 |
2등급=국소: 팔을 움직일 때 아픔; 전신: 일상생활에 영향을 줌
3등급=국소 및 전신: 일상생활 방해
*: 접종 당일 및 접종 후 14일
1): 구강체온
2): 구역, 구토, 설사 및/또는 복통을 포함하는 위장관계 증상.◦ 미국 성인 대상 안전성 시험에서의 명시되지 않은 이상사례
접종 후 31일내에 보고된 명시되지 않은 이상사례의 발생율은 두 군에서 유사하였다(이 백신 투여군: 17.8%, Tdap 투여군: 22.2%).
3) 국내 시판 후 조사
국내에서 6년 동안 672명을 대상으로 실시한 시판 후 사용성적조사 결과, 이상사례 발현율은 13.39%(90명/672명, 124건)이었고 이 중 이 약과 인과관계를 배제할 수 없는 약물이상반응 발현율은 5.21%(35명/672명, 51건)로 주사부위통증 3.13%(21명/672명, 22건), 주사부위부기 0.60%(4명/672명, 4건), 주사부위뭉침, 주사부위가려움이 각각 0.45%(3명/672명, 3건), 주사부위발진, 주사부위누름통증, 근육통이 각각 0.30%(2명/672명, 2건), 주사부위발적, 주사부위무감각, 주사부위반응, 주사부위온감, 설사, 감기, 기침, 콧물, 발열, 오한, 피로, 관절통, 발진이 각각 0.15%(1명/672명, 1건)가 보고되었다.
중대한 이상사례 발현율은 0.89%(6명/672명, 6건)로 질출혈 0.30%(2명/672명, 2건), 발열, 위장염, 생식기감염, 조산이 각각 0.15%(1명/672명, 1건)이며 이 약과 인과관계를 배제할 수 없는 중대한 약물이상반응은 확인되지 않았다.
예상하지 못한 이상사례 발현율은 8.04%(54명/672명, 65건)로 변비 2.08%(14명/672명, 14건), 소화불량 0.74%(5명/672명, 5건), 감기, 조기진통이 각각 0.60%(4명/672명, 4건), 주사부위가려움 0.45%(3명/672명, 3건), 주사부위발진, 소장대장염, 호흡곤란, 흉막삼출, 질분비물, 질출혈, 농뇨가 각각 0.30%(2명/672명, 2건), 오한, 골격통, 콧물, 가래질환, 귀울림, 주사부위온감, 주사부위무감각, 위장염, 위식도역류, 과민성대장증후군, 두근거림, 혈압상승, 심장비대, 자간전증, 생식기감염, 생식기소양증, 질염, 조산, 태아운동감소, 세균뇨, 대상포진이 각각 0.15%(1명/672명, 1건)가 보고되었다.
이 중 이 약과 인과관계를 배제할 수 없는 예상하지 못한 약물이상반응 발현율은 1.19%(8명/672명, 10건)로 주사부위가려움 0.45%(3명/672명, 3건), 주사부위발진 0.30%(2명/672명, 2건), 주사부위무감각, 주사부위온감, 감기, 콧물, 오한이 각각 0.15%(1명/672명, 1건)가 보고되었다.
중대하고 예상하지 못한 이상사례 발현율은 0.74%(5명/672명, 5건)로 질출혈 0.30%(2명/672명, 2건), 위장염, 조산, 생식기감염이 각각 0.15%(1명/672명, 1건)가 보고되었다. 이 중 중대하고 예상하지 못한 약물이상반응은 확인되지 않았다.
이 약에 대한 국내 재심사 이상사례 및 자발적 부작용 보고 자료를 국내 시판 허가된 모든 의약품을 대상으로 보고된 이상사례 보고자료(1989‑2016.10)와 재심사 종료시점에서 통합 평가한 결과, 다른 모든 의약품에서 보고된 이상사례에 비해 이 약에서 통계적으로 유의하게 많이 보고된 이상사례 중 새로 확인된 것들은 다음과 같다. 다만, 이 결과가 해당성분과 다음의 이상사례 간에 인과관계를 입증된 것을 의미하는 것은 아니다.
◦ 전신 및 투여 부위 이상 : 오한으로인한떨림, 주사부위연조직염
4) 국내 시판 후 새롭게 확인된 약물이상반응은 다음과 같다.
신경계 : 길랑‑바레 증후군
감염 및 기생충 감염: 뇌염
4. 일반적 주의
1) 백신 접종 전에, 병력(특히, 이전 접종 및 바람직하지 않은 반응의 발생 가능성에 대하여) 검토 및 진찰이 선행되는 것이 좋다.
2) 다른 모든 주사용 백신처럼, 백신 접종 후 발생할 수 있는 아나필락시 반응에 대비하여 적절한 응급조치를 준비한다.
3) Human Immunodeficiency Virus(HIV) 감염은 접종금기로 간주되지 않는다. 면역이 억제된 환자에게는 접종 후 기대하는 면역반응이 나타나지 않을 수도 있다.
4) 다른 백신처럼, 방어면역반응이 모든 피접종자에서 나타날 수는 없다.
5) 이 백신은 백일해 접종을 받지 않았거나, 백일해 기초 접종을 완료하지 못한 자에게 투여할 수 있다. 그러나, 추가 접종에 대한 이차면역반응(booster response)은 기초 접종을 받았거나 자연 감염되었던 환자에서만 일어날 수 있다.
6) 이 백신은 운전하거나 기계를 사용하는 데 있어, 영향을 미치지 않을 것 같다.
7) 본 백신은 치료목적으로는 사용하지 않는다.
8) 이전에 파상풍톡소이드를 포함하는 백신을 접종 받고 6주 이내에 길랑‑바레 증후군이 나타난 경우, 부스트릭스와 같은 파상풍톡소이드를 함유하는 백신을 이후에 접종받을 때 길랑‑바레 증후군의 위험이 증가할 수 있다.
9) DTPa, DTPa 혼합백신 접종 후 2~3일 내에 실신 또는 쇼크 유사 상태(저긴장성‑저반응성 에피소드) 및 경련이 매우 드물게 보고되었다.
10) 주사침 투여로 인한 심리적 반응으로서, 백신 접종 후 또는 접종 이전에도 실신이 발생할 수 있다. 실신으로 인한 상해를 예방할 수 있는 절차가 준비되어 있는 것이 중요하다.
5. 상호작용
1) 이 백신은 필요시에 다른 백신 또는 면역글로불린과 동시에 투여할 수 있다. 만약, 이 백신을 다른 백신 또는 면역글로불린과 동시에 투여할 경우, 다른 접종부위에 투여하여야 한다.
2) 다른 백신처럼, 면역억제요법을 받고 있는 환자 또는 면역결핍 환자에게서는 충분한 반응이 나타나지 않을 수 있다.
3) 이 백신과 플루아릭스가 동시투여되었을때 불활화백일해균선모적혈구응집소(FHA) 및 불활화백일해균69kDa외막단백질(PRN)의 기하평균농도(GMC)가 단독군보다 낮았다.
6. 임부 및 수유부에 대한 투여
1) 수태능
사람에서의 자료는 없다. 동물 연구에서는 암컷의 수태능에 직접 또는 간접적인 유해한 영향을 나타내지 않았다.
2) 임부
이 백신은 임신 3기에 투여할 수 있다.
임신 3기의 임부에게 이 백신을 투여한 무작위 배정 임상시험(341례의 임부) 및 전향적 관찰 연구의 안전성 자료(793례의 임부(737명의 신생아 추적자료))에서 임신 또는 태아/신생아의 건강에 미치는 백신과 관련된 유해 영향은 관찰되지 않았다. 임신 1기 및 2기 동안의 이 백신 또는 부스트릭스 폴리오(Tdap‑IPV 백신) 투여에 대한 전향적 임상시험을 통한 안전성 자료는 없다.
그러나 다른 불활화 백신과 마찬가지로, 이 백신은 태아에 유해한 영향을 나타낼 것으로 예상되지 않는다.
동물 연구에서는 임신, 배▪태자 발생, 분만 또는 출생 후 발생에 직접 또는 간접적인 유해한 영향을 나타내지 않았다.
3) 수유부
수유부에서 이 백신의 안전성을 평가하지 않았다. 이 백신이 모유로 분비되는지는 알려져 있지 않다. 이 백신은 유익성이 위험성을 상회할 때에만 수유부에게 접종해야 한다.
7. 고령자에 대한 투여
1) 고령자를 대상으로 한 임상시험(미국)에서 이 백신을 투여 받은 65세 이상의 고령자는 1,104명이며, 그 중 75세 이상의 고령자는 299명 이었다. 이 임상시험에 등록된 피험자의 연령의 중간값은 71.6세였다(범위 65~90세).
8. 적용상의 주의
1) 이 백신은 정맥, 피내, 피하주사 하여서는 안된다.
2) 사용시 균질한 백색의 현탁액이 되도록 잘 흔들어 사용한다.
3) 접종하기 전, 이물 및/또는 물리적 성상의 이상이 있는지 육안으로 확인한다. 이상이 관찰될 경우에 해당 백신은 투여하지 않는다.
4) 이 백신은 같은 주사기 내에서 다른 백신과 혼합하여서는 안 된다.
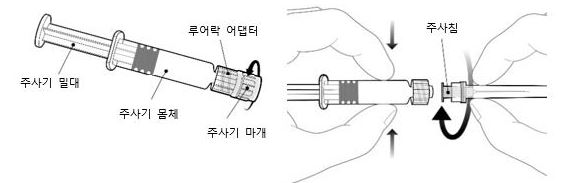
5) 프리필드시린지 사용방법은 다음과 같다.
(1) 주사기 몸체를 잡고(주사기 밀대를 잡지 않는다), 주사기 마개를 시계 반대방향으로 돌려 제거한다.
(2) 주사침을 루어락 어댑터에 연결하고 잠겼다고 느낄 때까지 1/4 정도 시계방향으로 돌려 넣어 주사침을 장착한다. 이 때 주사기 밀대를 주사기 몸체에서 빼지 않는다. 주사기 밀대가 주사기 몸체에서 분리될 경우, 백신을 투여해서는 안 된다.
9. 보관 및 취급상의 주의사항
1) 냉장(2~8℃), 차광 보관한다.
2) 냉동하지 않는다. 동결되었을 경우 폐기한다.
3) 안정성 데이터에 따르면 이 백신은 최대 37°C에서 7일 동안 안정하다. 보관 온도를 초과하여 노출된 경우(최대 37°C) 노출된 시점으로부터 7일 이내 사용되거나 폐기되어야 한다.
10. 전문가를 위한 정보
1) 임신 3기에 예방접종을 한 모체에게서 태어난 영아(생후 3개월 미만)의 백일해에 대한 수동면역
무작위배정, 교차설계, 위약 대조군 연구에서 임신 3기(27주~36주)에 부스트릭스를 투여 받은 모체에게서 태어난 신생아(N=291)의 제대혈에서 위약 대조군(N=292)과 비교하여 더 높은 백일해 항체농도가 관찰되었다. 부스트릭스를 투여 받은 모체에게서 태어난 신생아의 제대혈에서 백일해 항원 PT, FHA, 및 PRN에 대한 항체 농도는 대조군에 비해서 각각 8, 16, 그리고 21배 높게 나타났다. 이러한 항체 역가는 백일해에 대한 수동면역을 제공할 수 있다.
2) 임신 3기에 예방접종을 한 모체에게서 태어난 영아에서의 면역원성
예방접종을 한 모체에게서 태어난 500명 이상의 영아에 대한 추적 임상시험에서 임상 데이터는 디프테리아, 파상풍, B형 간염, 불활화 폴리오 바이러스, 또는 헤모필루스 인플루엔자 비형 항원에 대한 영아의 면역 반응과 모체의 예방접종 간 임상적으로 관련된 간섭을 보이지 않았다. 다만, 예방접종을 한 모체에게서 태어난 영아들의 기초(primary) 접종 후, 추가(booster) 접종 후 항체 농도가 더 낮은 몇 개의 백일해 항원들이 있었지만, 영아의 92.1‑98.1%가 모든 백일해 항원에 대하여 이차면역반응(booster response)을 보였다. 현재의 백일해 역학 자료들은 해당 면역 간섭에 의한 임상적 관련성은 알려지지 않았다.
3) 임신 3기에 이 백신(백신군) 또는 위약(대조군)을 접종한 모체에서 태어난 신생아 제대혈에서의 백일해 항체 농도 및 영아의 기초(primary) 접종 후, 추가(booster) 접종 후 백일해 항체 농도는 아래와 같다.
|
|
|
|
분석시점 |
대상자수 |
≥cut-off(%) (95% Cl) |
GMC (95% Cl) |
|
anti-PT |
백신군 |
신생아 |
제대혈 |
290 |
98.6 (96.5, 99.6) |
46.9 (41.2, 53.3) |
|
영아 |
기초접종 전 |
242 |
90.1 (85.6, 93.5) |
11.9 (10.3, 13.6) | ||
|
기초접종 후 |
266 |
100 (98.6, 100) |
32.7 (30.2, 35.3) | |||
|
추가접종 전 |
223 |
68.6 (62.1, 74.6) |
4.4 (3.8, 5.0) | |||
|
추가접종 후 |
221 |
99.5 (97.5, 100) |
52.4 (46.9, 58.4) | |||
|
대조군 |
신생아 |
제대혈 |
292 |
68.8 (63.2, 74.1) |
5.5 (4.8, 6.3) | |
|
영아 |
기초접종 전 |
253 |
34.8 (28.9, 41.0) |
2.2 (2.0, 2.5) | ||
|
기초접종 후 |
271 |
100 (98.6, 100) |
54.7 (51.0, 58.6) | |||
|
추가접종 전 |
244 |
82.4 (77.0, 86.9) |
6.3 (5.5, 7.1) | |||
|
추가접종 후 |
247 |
100 (98.5, 100) |
80.3 (73.3, 88.1) | |||
|
anti-FHA |
백신군 |
신생아 |
제대혈 |
291 |
100 (98.7, 100) |
366.1 (329.0, 407.3) |
|
영아 |
기초접종 전 |
242 |
100 (98.5, 100) |
88.3 (77.7, 100.4) | ||
|
기초접종 후 |
266 |
100 (98.6, 100) |
68.5 (63.5, 73.9) | |||
|
추가접종 전 |
223 |
96.4 (93.1, 98.4) |
11.2 (9.6, 13.1) | |||
|
추가접종 후 |
221 |
100 (98.3, 100) |
152.5 (136.3, 170.6) | |||
|
대조군 |
신생아 |
제대혈 |
292 |
96.6 (93.8, 98.3) |
22.7 (19.7, 26.2) | |
|
영아 |
기초접종 전 |
253 |
83.0 (77.8, 87.4) |
6.6 (5.7, 7.7) | ||
|
기초접종 후 |
271 |
100 (98.6, 100) |
103.5 (95.6, 112.1) | |||
|
추가접종 전 |
244 |
98.8 (96.4, 99.7) |
16.5 (14.4, 18.8) | |||
|
추가접종 후 |
247 |
100 (98.5, 100) |
187.2 (172.7, 202.9) | |||
|
anti-PRN |
백신군 |
신생아 |
제대혈 |
290 |
99.7 (98.1, 100) |
301.8 (250.9, 362.9) |
|
영아 |
기초접종 전 |
242 |
95.5 (92.0, 97.7) |
70.5 (56.1, 88.5) | ||
|
기초접종 후 |
266 |
100 (98.6, 100) |
60.5 (54.2, 67.6) | |||
|
추가접종 전 |
223 |
83.9 (78.4, 88.4) |
6.9 (5.8, 8.2) | |||
|
추가접종 후 |
220 |
100 (98.3, 100) |
333.9 (285.4, 390.7) | |||
|
대조군 |
신생아 |
제대혈 |
291 |
88.0 (83.7, 91.5) |
14.6 (12.1, 17.7) | |
|
영아 |
기초접종 전 |
253 |
59.7 (53.4, 65.8) |
4.5 (3.7, 5.4) | ||
|
기초접종 후 |
270 |
99.6 (98.0, 100) |
92.0 (81.6, 103.6) | |||
|
추가접종 전 |
244 |
87.3 (82.5, 91.2) |
9.6 (8.3, 11.2) | |||
|
추가접종 후 |
247 |
100 (98.5, 100) |
262.3 (230.9, 298.1) |
4) 폐쇄성 기도 질환에 대한 치료를 받는 환자에서의 면역 반응 및 안전성 프로파일
이 백신의 안전성과 면역원성은 천식이나 만성폐쇄성폐질환(COPD)과 같은 폐쇄성 기도 질환에 대한 치료를 받는 동안 이 백신을 접종 받은 222명의 시험대상자 (18세 이상) 데이터를 결합한 기술적 메타 분석 연구 (descriptive meta‑analysis study)를 통해 평가하였다. 접종 1개월 후 디프테리아와 파상풍 항원에 대한 혈청방어율 (seroprotective rate, ≧ 0.1 IU/mL)은 각각 89.0%와 97.2%이며, 백일해 항원 PT, FHA, PRN에 대한 이차면역반응 (booster response)은 각각 78.3%, 96.1%, 92.2% 이다. 이러한 결과는 일반 성인 모집단에서 얻은 반응과 일치하며 유사한 안전성 프로파일을 보인다.
복약정보
임부의 임신 3기 예방접종(maternal immunization)을 통한 영아 초기의 백일해에 대한 수동면역
단, 디프테리아 ◦파상풍 톡소이드가 함유된 백신을 추가 접종 받은 사람의 경우, 접종 후 5년 이내에는 본 백신의 접종을 피한다.
1회 투여용량(0.5mL)을 삼각근에 근육주사하며 혈관 내 직접 투여하지 않는다.
사용전 충분히 흔들어서 사용한다.
파상풍 톡소이드가 필요한 자가 파상풍이 발생하기 쉬운 상처(예: 먼지, 분변, 흙 및 침으로 오염된 상처; 관통상 등)를 입은 경우, 5년 이내 파상풍 톡소이드에 백신 접종력이 없는 경우 본 백신을 성인용 디프테리아‑파상풍 백신 대용으로 사용할 수 있다.
(주의: 본 백신은 영 ◦ 유아에 대한 기초접종에 사용할 수 없다. 즉 영 ◦ 유아 시기의 표준예방접종은 소아용 DTaP를 접종하여야 한다.)
1) 이전에 디프테리아, 파상풍 또는 백일해 백신 접종 후 과민반응을 보인 자 또는 이 백신의 성분에 대하여 과민반응이 있는 자
2) 이전에 백일해 성분을 함유하는 백신 접종 후 7일 이내에 병인이 알려지지 않은 뇌병증을 경험한 자. 이 때는 백일해 백신 접종을 중지하고, 디프테리아‑파상풍 백신을 사용하여야 한다.
3) 이전에 디프테리아 및/또는 파상풍 접종 후, 일시적인 혈소판 감소증 또는 신경학적 합병증을 경험한 자
2. 다음 환자에는 신중히 투여할 것
1) 다른 백신처럼, 급성중증열성 질환자의 경우 접종을 연기해야 한다. 그러나, 경미한 감염은 접종 금기가 아니다.
2) 혈소판 감소증 혹은 혈액 응고장애가 있는 자에게는 근육주사 후 출혈이 발생할 수 있으므로 주의하여야 한다. 주사부위를 문지르지 않고 2분 이상 눌러준다.
3) 백일해 접종 후, 백일해 접종과 관련될 수 있는 아래 반응 중 하나라도 발생했다면, 백일해 성분을 함유하는 백신을 투여할지 여부를 신중히 고려해야 한다.
‑ 확인 가능한 다른 원인에 의한 것이 아닌, 백신접종 후 48시간 이내에 발생하는 40℃ 이상의 열
‑ 백신 접종 후 48시간 이내의 허탈 또는 쇼크같은 상태(근육긴장저하‑무반사)
‑ 백신 접종 후 48시간 이내에 발생하는 3시간 이상 계속되는 지속적이고 달랠 수 없는 울음
‑ 백신 접종 후 3일 이내에 발생하는 열을 동반한 또는 동반하지 않은 경련
이런 경우에도, 백일해 유행 시기와 같이 접종에 의한 잠재적인 유익성이 발생 가능한 위험성을 상회하는 상황에서는 접종을 고려할 수 있다.
4) DTP를 접종한 후, 경련의 병력이 있거나 경련이나 이상사례에 대한 가족력이 있는 것은 접종금기사항은 아니나 신중 투여를 요한다.
5) 이전에 파상풍톡소이드를 포함하는 백신 접종 후 6주 이내에 길랑‑바레 증후군이 나타났을 경우, 이 백신이나 파상풍 톡소이드를 함유하는 백신의 접종 여부는 위험성과 유익성을 고려하여 결정되어야 한다.
6) 진행성 신경계 질환, 조절 불가능한 뇌전증 또는 진행성 뇌병증 환자 또는 불안정한 신경상태(예, 뇌혈관발적 및 급성 뇌병증)의 환자인 경우 본 백신이나 백일해 항원을 함유하는 백신의 접종 여부를 위험성과 유익성을 고려하여 신중히 결정되어야 한다.
7) 이전에 파상풍 톡소이드 함유 백신을 접종 받은 후, 아루투스 타입의 과민 반응(Arthus‑Type Hypersensitivity)을 경험한 자는 보통 혈중 파상풍 항독소 수치가 높다. 이전에 파상풍 톡소이드 함유 백신을 마지막으로 투여한 후 최소 10년 이내에는 본 백신이나 파상풍 톡소이드를 함유하는 다른 백신을 접종받아서는 안된다.
3. 약물이상반응
1) 임상시험
약 3,000명의 피험자가 임상시험에서 이 백신 1회 용량을 투여받았다.
백신 접종 후 가장 빈번하게 일어난 반응은 주사부위 국소반응(통증, 발적 및 부종)으로, 각 임상시험에서 피험자의 50~92%에서 관찰되었다. 이들 반응은 백신 접종 후 48시간 이내에 나타났으며, 모든 증상은 후유증 없이 소실되었다.
아래의 안전성 프로파일은 1,931명의 소아(10세 이상), 청소년 및 성인에게 이 백신을 투여한 임상시험자료에 근거한다.
보고된 약물이상반응은 다음 빈도에 따라 나열하였다.
매우 흔함 (≧10%)
흔함 (≧1% 및 ˂10%)
흔하지 않음 (≧0.1% 및 ˂1%)
드물게 (≧0.01% 및 ˂0.1%)
매우 드물게 (˂0.01%)
◦ 전신 이상 및 투여부위 증상:
‑ 매우 흔함: 주사부위 반응(통증, 발적 및 부종 포함), 피로, 불쾌감
‑ 흔함: 발열(≧37.5℃), 주사부위 반응(주사부위 뭉침 및 주사부위의 무균성 농양)
‑ 흔하지 않음: 발열(>39.0℃), 인플루엔자 유사 질환, 통증
◦ 신경계 이상
‑ 매우 흔함: 두통
‑ 흔함: 현기증
‑ 흔하지 않음: 실신
◦ 위장관계 이상
‑ 흔함: 구역, 위장관계 이상
‑ 흔하지 않음: 설사, 구토
◦ 근골격근 및 결합조직 이상
‑ 흔하지 않음: 관절통, 근육통, 관절 경직, 근골격 경직
◦ 피부 및 피하조직 이상
‑ 흔하지 않음: 다한증, 소양증, 발진
◦ 혈액 및 림프계 이상
‑ 흔하지 않음: 림프절병증
◦ 감염
‑ 흔하지 않음: 상기도감염, 인두염
◦ 호흡기, 흉부 및 종격 이상
‑ 흔하지 않음: 기침
2) 해외 시판 후 조사
◦ 혈액 및 림프계 이상
‑ 드물게: 혈관부종
◦ 면역계 이상
‑ 매우 드물게: 아나필락시 반응 및 아나필락시 양반응을 포함하는 알레르기 반응
◦ 신경계 이상
‑ 드물게: 경련(발열 동반 또는 발열 동반하지 않음)
◦ 피부 및 피하조직 이상
‑ 드물게: 두드러기
◦ 전신 이상 및 주사부위 반응
‑ 드물게: 투여된 사지의 광범위한 부종, 무력증
추가로 첨가제 구성이 다른 미국의 부스트릭스에 대한 임상시험 결과에 따른 이상사례는 다음과 같다.
10~18세의 미국 청소년을 대상으로 한 임상시험에서 3,080명은 이 백신을, 1,034명은 Td백신을 1회 투여받았다. 그리고 미국에서, 19~64세의 성인 2,284 명을 대상으로 이 백신의 안전성을 미국에서 허가된 다른 Tdap 백신과 비교 평가하는 임상시험이 실시되었다.
◦ 미국 청소년 대상 안전성 시험에서의 명시된 이상사례
표 1은 총 접종 코호트(total vaccinated cohort)에서 이 백신 또는 Td 백신 접종 15일 이내에 발생한 명시된 국소이상사례 및 전신이상사례를 보여준다.
이 백신 투여군 중 4.6%, Td 백신 접종군 중 4.0%가 3등급의 접종부위 통증(건드리지 않아도 아픔 및/또는 일상생활 방해)을 보고하였다. 3등급의 통증 관련 발생율 차이는 사전에 정의된 비열등성에 대한 임상 범위 내에 속하였다.
표 1. 10~18세 청소년을 대상으로, 접종 후 15*일 이내의 명시된 국소이상사례 또는 전신이상사례 발생율(총 접종 코호트)
|
|
이 백신 (N=3,032) % |
Td (N=1,013) % |
|
국소 | ||
|
통증, 모든1) 통증, 2 또는 3등급1) 통증, 3등급2) |
75.3 51.2 4.6 |
71.7 42.5 4.0 |
|
발적, 모든 발적, > 20mm 발적, ≥ 50mm |
22.5 4.1 1.7 |
19.8 3.9 1.6 |
|
부종, 모든 부종, > 20mm 부종, ≥ 50mm |
21.1 5.3 2.5 |
20.1 4.9 3.2 |
|
팔둘레 증가, >5 mm3) 팔둘레 증가, >20 mm3) 팔둘레 증가, >40 mm3) |
28.3 2.0 0.5 |
29.5 2.2 0.3 |
|
전신 |
|
|
|
발열, ≥37.5℃4) 발열, > 38℃4) 발열, > 39℃4) |
13.5 5.0 1.4 |
13.1 4.7 1.0 |
|
두통, 모든 두통, 2 또는 3등급1) 두통, 3등급 |
43.1 15.7 3.7 |
41.5 12.7 2.7 |
|
피로, 모든 피로, 2 또는 3등급 피로, 3등급 |
37.0 14.4 3.7 |
36.7 12.9 3.2 |
|
위장관계 증상, 모든5) 위장관계 증상, 2 또는 3등급5) 위장관계 증상, 3등급5) |
26.0 9.8 3.0 |
25.8 9.7 3.2 |
2등급=국소: 팔을 움직일 때 아픔; 전신: 일상생활에 영향을 줌
3등급=국소: 건드리지 않아도 아픔 및/또는 일상생활 방해; 전신: 일상생활 방해
*: 접종 당일 및 접종 14일 후
1): Td백신과 비교하였을 때, 이 백신에서 통계적으로 유의하게 더 높음(p˂0.05)
2): 3등급 접종부위 통증 관련, Td백신과 비교하였을 때, 이 백신은 열등하지 않음
3): 접종받은 팔의 중간 상완
4): 구강 또는 액와 체온
5): 구역, 구토, 설사 및/또는 복통을 포함하는 위장관계 증상◦ 미국 청소년 대상 안전성 시험에서의 명시되지 않은 이상사례
접종 후 31일내에 보고된 명시되지 않은 이상사례의 발생율은 두 군에서 유사하였다(이 백신 투여군: 25.4%, Td 투여군: 24.5%).
◦ 미국 성인 대상 안전성 시험에서의 명시된 이상사례
표 2는 총 접종 코호트(total vaccinated cohort)에서 이 백신 또는 다른 Tdap 백신 접종 15일 이내에 발생한 명시된 국소이상사례 및 전신이상사례를 보여준다.
표 2 성인을 대상으로, 접종 후 15*일 이내의 명시된 국소이상사례 또는 전신이상사례 발생율(총 접종 코호트)
|
|
이 백신 (N=1,480) % |
Tdap (N=741) % |
|
국소 | ||
|
통증, 모든 통증, 2 또는 3등급 통증, 3등급 |
61.0 35.1 1.6 |
69.2 44.4 2.3 |
|
발적, 모든 발적, > 20mm 발적, ≥ 50mm |
21.1 4.0 1.6 |
27.1 6.2 2.3 |
|
부종, 모든 부종, > 20mm 부종, ≥ 50mm |
17.6 3.9 1.4 |
25.6 6.3 2.8 |
|
전신 |
||
|
발열, ≥ 37.5℃1) 발열, > 38℃1) 발열, > 39℃1) |
5.5 1.0 0.1 |
8.0 1.5 0.4 |
|
두통, 모든 두통, 2 또는 3등급 두통, 3등급 |
30.1 11.1 2.2 |
31.0 10.5 1.5 |
|
피로, 모든 피로, 2 또는 3등급 피로, 3등급 |
28.1 9.1 2.5 |
28.9 9.4 1.2 |
|
위장관계 증상, 모든2) 위장관계 증상, 2 또는 3등급2) 위장관계 증상, 3등급2) |
15.9 4.3 1.2 |
17.5 5.7 1.3 |
2등급=국소: 팔을 움직일 때 아픔; 전신: 일상생활에 영향을 줌
3등급=국소 및 전신: 일상생활 방해
*: 접종 당일 및 접종 후 14일
1): 구강체온
2): 구역, 구토, 설사 및/또는 복통을 포함하는 위장관계 증상.◦ 미국 성인 대상 안전성 시험에서의 명시되지 않은 이상사례
접종 후 31일내에 보고된 명시되지 않은 이상사례의 발생율은 두 군에서 유사하였다(이 백신 투여군: 17.8%, Tdap 투여군: 22.2%).
3) 국내 시판 후 조사
국내에서 6년 동안 672명을 대상으로 실시한 시판 후 사용성적조사 결과, 이상사례 발현율은 13.39%(90명/672명, 124건)이었고 이 중 이 약과 인과관계를 배제할 수 없는 약물이상반응 발현율은 5.21%(35명/672명, 51건)로 주사부위통증 3.13%(21명/672명, 22건), 주사부위부기 0.60%(4명/672명, 4건), 주사부위뭉침, 주사부위가려움이 각각 0.45%(3명/672명, 3건), 주사부위발진, 주사부위누름통증, 근육통이 각각 0.30%(2명/672명, 2건), 주사부위발적, 주사부위무감각, 주사부위반응, 주사부위온감, 설사, 감기, 기침, 콧물, 발열, 오한, 피로, 관절통, 발진이 각각 0.15%(1명/672명, 1건)가 보고되었다.
중대한 이상사례 발현율은 0.89%(6명/672명, 6건)로 질출혈 0.30%(2명/672명, 2건), 발열, 위장염, 생식기감염, 조산이 각각 0.15%(1명/672명, 1건)이며 이 약과 인과관계를 배제할 수 없는 중대한 약물이상반응은 확인되지 않았다.
예상하지 못한 이상사례 발현율은 8.04%(54명/672명, 65건)로 변비 2.08%(14명/672명, 14건), 소화불량 0.74%(5명/672명, 5건), 감기, 조기진통이 각각 0.60%(4명/672명, 4건), 주사부위가려움 0.45%(3명/672명, 3건), 주사부위발진, 소장대장염, 호흡곤란, 흉막삼출, 질분비물, 질출혈, 농뇨가 각각 0.30%(2명/672명, 2건), 오한, 골격통, 콧물, 가래질환, 귀울림, 주사부위온감, 주사부위무감각, 위장염, 위식도역류, 과민성대장증후군, 두근거림, 혈압상승, 심장비대, 자간전증, 생식기감염, 생식기소양증, 질염, 조산, 태아운동감소, 세균뇨, 대상포진이 각각 0.15%(1명/672명, 1건)가 보고되었다.
이 중 이 약과 인과관계를 배제할 수 없는 예상하지 못한 약물이상반응 발현율은 1.19%(8명/672명, 10건)로 주사부위가려움 0.45%(3명/672명, 3건), 주사부위발진 0.30%(2명/672명, 2건), 주사부위무감각, 주사부위온감, 감기, 콧물, 오한이 각각 0.15%(1명/672명, 1건)가 보고되었다.
중대하고 예상하지 못한 이상사례 발현율은 0.74%(5명/672명, 5건)로 질출혈 0.30%(2명/672명, 2건), 위장염, 조산, 생식기감염이 각각 0.15%(1명/672명, 1건)가 보고되었다. 이 중 중대하고 예상하지 못한 약물이상반응은 확인되지 않았다.
이 약에 대한 국내 재심사 이상사례 및 자발적 부작용 보고 자료를 국내 시판 허가된 모든 의약품을 대상으로 보고된 이상사례 보고자료(1989‑2016.10)와 재심사 종료시점에서 통합 평가한 결과, 다른 모든 의약품에서 보고된 이상사례에 비해 이 약에서 통계적으로 유의하게 많이 보고된 이상사례 중 새로 확인된 것들은 다음과 같다. 다만, 이 결과가 해당성분과 다음의 이상사례 간에 인과관계를 입증된 것을 의미하는 것은 아니다.
◦ 전신 및 투여 부위 이상 : 오한으로인한떨림, 주사부위연조직염
4) 국내 시판 후 새롭게 확인된 약물이상반응은 다음과 같다.
신경계 : 길랑‑바레 증후군
감염 및 기생충 감염: 뇌염
4. 일반적 주의
1) 백신 접종 전에, 병력(특히, 이전 접종 및 바람직하지 않은 반응의 발생 가능성에 대하여) 검토 및 진찰이 선행되는 것이 좋다.
2) 다른 모든 주사용 백신처럼, 백신 접종 후 발생할 수 있는 아나필락시 반응에 대비하여 적절한 응급조치를 준비한다.
3) Human Immunodeficiency Virus(HIV) 감염은 접종금기로 간주되지 않는다. 면역이 억제된 환자에게는 접종 후 기대하는 면역반응이 나타나지 않을 수도 있다.
4) 다른 백신처럼, 방어면역반응이 모든 피접종자에서 나타날 수는 없다.
5) 이 백신은 백일해 접종을 받지 않았거나, 백일해 기초 접종을 완료하지 못한 자에게 투여할 수 있다. 그러나, 추가 접종에 대한 이차면역반응(booster response)은 기초 접종을 받았거나 자연 감염되었던 환자에서만 일어날 수 있다.
6) 이 백신은 운전하거나 기계를 사용하는 데 있어, 영향을 미치지 않을 것 같다.
7) 본 백신은 치료목적으로는 사용하지 않는다.
8) 이전에 파상풍톡소이드를 포함하는 백신을 접종 받고 6주 이내에 길랑‑바레 증후군이 나타난 경우, 부스트릭스와 같은 파상풍톡소이드를 함유하는 백신을 이후에 접종받을 때 길랑‑바레 증후군의 위험이 증가할 수 있다.
9) DTPa, DTPa 혼합백신 접종 후 2~3일 내에 실신 또는 쇼크 유사 상태(저긴장성‑저반응성 에피소드) 및 경련이 매우 드물게 보고되었다.
10) 주사침 투여로 인한 심리적 반응으로서, 백신 접종 후 또는 접종 이전에도 실신이 발생할 수 있다. 실신으로 인한 상해를 예방할 수 있는 절차가 준비되어 있는 것이 중요하다.
5. 상호작용
1) 이 백신은 필요시에 다른 백신 또는 면역글로불린과 동시에 투여할 수 있다. 만약, 이 백신을 다른 백신 또는 면역글로불린과 동시에 투여할 경우, 다른 접종부위에 투여하여야 한다.
2) 다른 백신처럼, 면역억제요법을 받고 있는 환자 또는 면역결핍 환자에게서는 충분한 반응이 나타나지 않을 수 있다.
3) 이 백신과 플루아릭스가 동시투여되었을때 불활화백일해균선모적혈구응집소(FHA) 및 불활화백일해균69kDa외막단백질(PRN)의 기하평균농도(GMC)가 단독군보다 낮았다.
6. 임부 및 수유부에 대한 투여
1) 수태능
사람에서의 자료는 없다. 동물 연구에서는 암컷의 수태능에 직접 또는 간접적인 유해한 영향을 나타내지 않았다.
2) 임부
이 백신은 임신 3기에 투여할 수 있다.
임신 3기의 임부에게 이 백신을 투여한 무작위 배정 임상시험(341례의 임부) 및 전향적 관찰 연구의 안전성 자료(793례의 임부(737명의 신생아 추적자료))에서 임신 또는 태아/신생아의 건강에 미치는 백신과 관련된 유해 영향은 관찰되지 않았다. 임신 1기 및 2기 동안의 이 백신 또는 부스트릭스 폴리오(Tdap‑IPV 백신) 투여에 대한 전향적 임상시험을 통한 안전성 자료는 없다.
그러나 다른 불활화 백신과 마찬가지로, 이 백신은 태아에 유해한 영향을 나타낼 것으로 예상되지 않는다.
동물 연구에서는 임신, 배▪태자 발생, 분만 또는 출생 후 발생에 직접 또는 간접적인 유해한 영향을 나타내지 않았다.
3) 수유부
수유부에서 이 백신의 안전성을 평가하지 않았다. 이 백신이 모유로 분비되는지는 알려져 있지 않다. 이 백신은 유익성이 위험성을 상회할 때에만 수유부에게 접종해야 한다.
7. 고령자에 대한 투여
1) 고령자를 대상으로 한 임상시험(미국)에서 이 백신을 투여 받은 65세 이상의 고령자는 1,104명이며, 그 중 75세 이상의 고령자는 299명 이었다. 이 임상시험에 등록된 피험자의 연령의 중간값은 71.6세였다(범위 65~90세).
8. 적용상의 주의
1) 이 백신은 정맥, 피내, 피하주사 하여서는 안된다.
2) 사용시 균질한 백색의 현탁액이 되도록 잘 흔들어 사용한다.
3) 접종하기 전, 이물 및/또는 물리적 성상의 이상이 있는지 육안으로 확인한다. 이상이 관찰될 경우에 해당 백신은 투여하지 않는다.
4) 이 백신은 같은 주사기 내에서 다른 백신과 혼합하여서는 안 된다.
5) 프리필드시린지 사용방법은 다음과 같다.
(1) 주사기 몸체를 잡고(주사기 밀대를 잡지 않는다), 주사기 마개를 시계 반대방향으로 돌려 제거한다.
(2) 주사침을 루어락 어댑터에 연결하고 잠겼다고 느낄 때까지 1/4 정도 시계방향으로 돌려 넣어 주사침을 장착한다. 이 때 주사기 밀대를 주사기 몸체에서 빼지 않는다. 주사기 밀대가 주사기 몸체에서 분리될 경우, 백신을 투여해서는 안 된다.
9. 보관 및 취급상의 주의사항
1) 냉장(2~8℃), 차광 보관한다.
2) 냉동하지 않는다. 동결되었을 경우 폐기한다.
3) 안정성 데이터에 따르면 이 백신은 최대 37°C에서 7일 동안 안정하다. 보관 온도를 초과하여 노출된 경우(최대 37°C) 노출된 시점으로부터 7일 이내 사용되거나 폐기되어야 한다.
10. 전문가를 위한 정보
1) 임신 3기에 예방접종을 한 모체에게서 태어난 영아(생후 3개월 미만)의 백일해에 대한 수동면역
무작위배정, 교차설계, 위약 대조군 연구에서 임신 3기(27주~36주)에 부스트릭스를 투여 받은 모체에게서 태어난 신생아(N=291)의 제대혈에서 위약 대조군(N=292)과 비교하여 더 높은 백일해 항체농도가 관찰되었다. 부스트릭스를 투여 받은 모체에게서 태어난 신생아의 제대혈에서 백일해 항원 PT, FHA, 및 PRN에 대한 항체 농도는 대조군에 비해서 각각 8, 16, 그리고 21배 높게 나타났다. 이러한 항체 역가는 백일해에 대한 수동면역을 제공할 수 있다.
2) 임신 3기에 예방접종을 한 모체에게서 태어난 영아에서의 면역원성
예방접종을 한 모체에게서 태어난 500명 이상의 영아에 대한 추적 임상시험에서 임상 데이터는 디프테리아, 파상풍, B형 간염, 불활화 폴리오 바이러스, 또는 헤모필루스 인플루엔자 비형 항원에 대한 영아의 면역 반응과 모체의 예방접종 간 임상적으로 관련된 간섭을 보이지 않았다. 다만, 예방접종을 한 모체에게서 태어난 영아들의 기초(primary) 접종 후, 추가(booster) 접종 후 항체 농도가 더 낮은 몇 개의 백일해 항원들이 있었지만, 영아의 92.1‑98.1%가 모든 백일해 항원에 대하여 이차면역반응(booster response)을 보였다. 현재의 백일해 역학 자료들은 해당 면역 간섭에 의한 임상적 관련성은 알려지지 않았다.
3) 임신 3기에 이 백신(백신군) 또는 위약(대조군)을 접종한 모체에서 태어난 신생아 제대혈에서의 백일해 항체 농도 및 영아의 기초(primary) 접종 후, 추가(booster) 접종 후 백일해 항체 농도는 아래와 같다.
|
|
|
|
분석시점 |
대상자수 |
≥cut-off(%) (95% Cl) |
GMC (95% Cl) |
|
anti-PT |
백신군 |
신생아 |
제대혈 |
290 |
98.6 (96.5, 99.6) |
46.9 (41.2, 53.3) |
|
영아 |
기초접종 전 |
242 |
90.1 (85.6, 93.5) |
11.9 (10.3, 13.6) | ||
|
기초접종 후 |
266 |
100 (98.6, 100) |
32.7 (30.2, 35.3) | |||
|
추가접종 전 |
223 |
68.6 (62.1, 74.6) |
4.4 (3.8, 5.0) | |||
|
추가접종 후 |
221 |
99.5 (97.5, 100) |
52.4 (46.9, 58.4) | |||
|
대조군 |
신생아 |
제대혈 |
292 |
68.8 (63.2, 74.1) |
5.5 (4.8, 6.3) | |
|
영아 |
기초접종 전 |
253 |
34.8 (28.9, 41.0) |
2.2 (2.0, 2.5) | ||
|
기초접종 후 |
271 |
100 (98.6, 100) |
54.7 (51.0, 58.6) | |||
|
추가접종 전 |
244 |
82.4 (77.0, 86.9) |
6.3 (5.5, 7.1) | |||
|
추가접종 후 |
247 |
100 (98.5, 100) |
80.3 (73.3, 88.1) | |||
|
anti-FHA |
백신군 |
신생아 |
제대혈 |
291 |
100 (98.7, 100) |
366.1 (329.0, 407.3) |
|
영아 |
기초접종 전 |
242 |
100 (98.5, 100) |
88.3 (77.7, 100.4) | ||
|
기초접종 후 |
266 |
100 (98.6, 100) |
68.5 (63.5, 73.9) | |||
|
추가접종 전 |
223 |
96.4 (93.1, 98.4) |
11.2 (9.6, 13.1) | |||
|
추가접종 후 |
221 |
100 (98.3, 100) |
152.5 (136.3, 170.6) | |||
|
대조군 |
신생아 |
제대혈 |
292 |
96.6 (93.8, 98.3) |
22.7 (19.7, 26.2) | |
|
영아 |
기초접종 전 |
253 |
83.0 (77.8, 87.4) |
6.6 (5.7, 7.7) | ||
|
기초접종 후 |
271 |
100 (98.6, 100) |
103.5 (95.6, 112.1) | |||
|
추가접종 전 |
244 |
98.8 (96.4, 99.7) |
16.5 (14.4, 18.8) | |||
|
추가접종 후 |
247 |
100 (98.5, 100) |
187.2 (172.7, 202.9) | |||
|
anti-PRN |
백신군 |
신생아 |
제대혈 |
290 |
99.7 (98.1, 100) |
301.8 (250.9, 362.9) |
|
영아 |
기초접종 전 |
242 |
95.5 (92.0, 97.7) |
70.5 (56.1, 88.5) | ||
|
기초접종 후 |
266 |
100 (98.6, 100) |
60.5 (54.2, 67.6) | |||
|
추가접종 전 |
223 |
83.9 (78.4, 88.4) |
6.9 (5.8, 8.2) | |||
|
추가접종 후 |
220 |
100 (98.3, 100) |
333.9 (285.4, 390.7) | |||
|
대조군 |
신생아 |
제대혈 |
291 |
88.0 (83.7, 91.5) |
14.6 (12.1, 17.7) | |
|
영아 |
기초접종 전 |
253 |
59.7 (53.4, 65.8) |
4.5 (3.7, 5.4) | ||
|
기초접종 후 |
270 |
99.6 (98.0, 100) |
92.0 (81.6, 103.6) | |||
|
추가접종 전 |
244 |
87.3 (82.5, 91.2) |
9.6 (8.3, 11.2) | |||
|
추가접종 후 |
247 |
100 (98.5, 100) |
262.3 (230.9, 298.1) |
4) 폐쇄성 기도 질환에 대한 치료를 받는 환자에서의 면역 반응 및 안전성 프로파일
이 백신의 안전성과 면역원성은 천식이나 만성폐쇄성폐질환(COPD)과 같은 폐쇄성 기도 질환에 대한 치료를 받는 동안 이 백신을 접종 받은 222명의 시험대상자 (18세 이상) 데이터를 결합한 기술적 메타 분석 연구 (descriptive meta‑analysis study)를 통해 평가하였다. 접종 1개월 후 디프테리아와 파상풍 항원에 대한 혈청방어율 (seroprotective rate, ≧ 0.1 IU/mL)은 각각 89.0%와 97.2%이며, 백일해 항원 PT, FHA, PRN에 대한 이차면역반응 (booster response)은 각각 78.3%, 96.1%, 92.2% 이다. 이러한 결과는 일반 성인 모집단에서 얻은 반응과 일치하며 유사한 안전성 프로파일을 보인다.