| 제품명 |
|
|||
|---|---|---|---|---|
| 성분 / 함량 | 동일성분 의약품 | |||
| 첨가제 | ||||
| 도핑금지 약물정보 |
경기기간중 : 허용 경기기간외 : 허용
상세정보 확인
※ 국소투여경로 등 예외 적용이 있을 수 있으니, KADA 누리집으로 연결되는 "상세정보 확인"을 클릭하여 주시기 바랍니다. |
|||
| 전문 / 일반 | 단일 / 복합 | |||
| 제조 / 수입사 | ||||
| 제형 | 투여경로 | |||
| 성상 | ||||
| 허가일 |
|
|||
| 재심사 | ||||
| 대조 / 생동 | ||||
| 급여평가결과 | 급여(B), 2017년 제04차 키트루다주(한국엠에스디(유)).pdf | |||
| 급여정보 |
655501901 - 2103620원/4mL/병 급여(2024-07-01) - 2107642원/4mL/병 급여(2022-03-01) - 2833278원/4mL/병 급여(2022-02-01) - 2833278원/4mL/병 급여(2022-01-01) - 2845449원/4mL/병 급여(2020-01-01) - 2846110원/4mL/병 급여(2018-02-05) - 2860412원/4mL/병 급여(2017-08-21)
|
|||
| 급여인정기준 |
· [일반원칙] 국민건강보험 요양급여의 기준에 관한 규칙 제5조제4항에 의하여 중증환자 중 암환자에게 처방·투여하는 약제로서 건강보험심사평가원장이 정하여 공고하는 약제의 범위 및 비용부담 , 2019.11.01
|
|||
| ATC 코드 | ||||
| 식약처 분류 | ||||
| KPIC 약효분류 |
|
|||
| KPIC 학술 |
팜리뷰
[Special Issue] 암 환자의 퇴원 후 관리, 약학정보원(최은경), 2022-12-30
팜리뷰
항암치료와 구내염, 약학정보원(최선), 2017-06-12
팜리뷰
완화치료(palliative care), 약학정보원(남궁형욱), 2017-05-15
팜리뷰
비만과 여성암(2), 약학정보원(최혁재), 2017-03-13
팜리뷰
비만과 여성암(1), 약학정보원(최혁재), 2017-03-06
팜리뷰
항암화학요법 시 부작용 경감을 위한 한방의 병용(I) - 소화기계 부작용, 약학정보원(송보완), 2017-02-20
|
|||
| 대한약사저널 |
약대약
[항암제] 여보이주 vs 키트루다주, 정경인 약사, 2022-10-24
이슈트랜드
암 위험인자로서의 비만, 약학정보원 학술정보센터, 2020-08-10
|
|||
| 제품설명서 | 보 기 ( 2017-10-10 게시 ) | |||
| 의약품안전성 정보(DUR) |
||||
| 포장단위 (식약처 기준) |
||||
| 저장방법 | ||||
사용자GNB바
컨텐츠
의약품 상세정보
허가정보 ∙ 복약정보
효능 · 효과
흑색종
2. 완전 절제술을 받은 IIB기, IIC기 또는 III기 흑색종 환자의 수술 후 보조요법(adjuvant) 치료
비소세포폐암
1. EGFR 또는 ALK 변이가 없는 전이성 비편평 비소세포폐암 환자에서의 1차 치료로서 페메트렉시드 및 백금 화학요법과의 병용 요법
2. 전이성 편평 비소세포폐암 환자에서의 1차 치료로서 카보플라틴 및 파클리탁셀(혹은 알부민 결합 파클리탁셀)과의 병용 요법
3. PD ‑L1 발현 양성(Tumor Proportion Score(TPS) ≧50%)으로서, EGFR 또는 ALK 변이가 없는 진행성 비소세포폐암 환자에서의 1차 치료
4. PD ‑L1 발현 양성(TPS ≧1%)으로서, 백금 기반 화학요법제 치료 도중 또는 이후에 진행이 확인된 진행성 비소세포폐암의 치료. 다만 EGFR 또는 ALK 변이가 확인된 환자는 이 약을 투여하기 전에 이러한 변이에 대한 승인된 치료제를 투여한 후에도 질병의 진행이 확인된 경우여야 한다.
5. 절제 가능한(종양 크기 4 cm 이상 또는 양성 림프절) 비소세포폐암 환자의 치료로서 수술 전 보조요법(neoadjuvant)으로 백금 기반 항암화학요법과 병용 요법, 그리고 이어서 수술 후 보조요법(adjuvant)으로 단독 요법
6. 절제술과 백금 기반 화학요법제 치료를 받은 IB기(T2a ≧ 4cm), II기 또는 IIIA기 비소세포폐암 환자에서의 수술 후 보조요법(adjuvant)으로서 단독 요법
악성 흉막 중피종
수술이 불가능한 진행성 또는 전이성 악성 흉막 중피종 환자의 1차 치료로서 페메트렉시드 및 백금 화학요법과의 병용 요법
두경부암
1. 전이성 또는 수술이 불가능한 재발성 두경부 편평상피세포암 환자에서의 1차 치료로서
◦ PD ‑L1 발현 양성(Combined Positive Score (CPS) ≧1)인 환자에서의 단독 요법
◦ 백금 및 플루오로우라실(5 ‑FU) 화학요법과의 병용 요법2. PD ‑L1 발현 양성(TPS ≧50%)으로서, 백금 기반 화학요법제 치료 도중 또는 이후에 진행이 확인된 전이성 또는 수술이 불가능한 재발성 두경부 편평상피세포암의 치료로서 단독 요법
전형적 호지킨 림프종
자가조혈모세포이식에 실패하거나, 자가조혈모세포이식이 치료 옵션이 아닌 경우 최소 두 가지 이상의 이전 요법에 실패한 재발성 또는 불응성인 전형적 호지킨 림프종 성인 및 2세 이상의 소아 환자의 치료
요로상피암
1. 국소 진행성 또는 전이성 요로상피암 환자의 1차 치료로서 엔포투맙베도틴과의 병용 요법
2. 백금 기반 항암화학요법이 불가능한 국소 진행성 또는 전이성 요로상피암의 치료
3. 백금 기반 화학요법제 치료 도중 또는 이후에 진행이 확인되거나, 백금기반의 수술 전 보조요법(neoadjuvant) 또는 수술 후 보조요법(adjuvant) 치료 12개월 이내에 진행이 확인된 국소 진행성 또는 전이성인 요로상피암의 치료
4. 방광 절제술이 불가능하거나 시행을 선택하지 않았으며, 유두종 유무에 상관없이 상피내암을 동반한 BCG ‑불응 고위험 비근침습성 방광암의 치료
위암
1. PD ‑L1 발현 양성(CPS ≧1)으로서, 수술이 불가능한 국소 진행성 또는 전이성 HER2 양성 위 또는 위식도접합부 선암 환자에서의 1차 치료로서 트라스투주맙과 플루오로피리미딘 및 백금 화학요법과의 병용 요법
2. 수술이 불가능한 국소 진행성 또는 전이성 HER2 음성 위 또는 위식도접합부 선암 환자에서의 1차 치료로서 플루오로피리미딘 및 백금 기반 화학요법과의 병용 요법
식도암
PD ‑L1 발현 양성(CPS ≧10)으로서, 수술이 불가능한 국소 진행성 또는 전이성 식도암이나 HER ‑2 음성인 위식도 접합부 선암(병변의 중심(epicenter)이 위식도 접합부 1 ‑5cm위에 위치) 환자에서의 1차 치료로서 백금 및 플루오로피리미딘 기반 화학요법과의 병용 요법
신세포암
1. 진행성 신세포암 환자에서의 1차 치료로서 엑시티닙과의 병용 요법
2. 진행성 신세포암 환자에서의 1차 치료로서 렌바티닙과의 병용 요법
3. 신장 절제술 이후 재발 위험이 중등 ‑고위험 또는 고위험이거나 신장 절제술 및 전이 병변 절제 이후인 신세포암 환자의 수술 후 보조요법(adjuvant) 치료로서 단독 요법 (사용상의 주의사항 14. 임상시험 정보항 참고)
자궁내막암
1. 새로 진단된 진행성 또는 재발성 자궁내막암 환자의 치료로서 카보플라틴 및 파클리탁셀과의 병용 요법
2. 이전의 전신 요법 이후 진행이 확인되고 수술적 치료 또는 방사선 치료가 부적합한, 고빈도 ‑현미부수체 불안정성(MSI ‑H, microsatellite instability high) 또는 불일치 복구 결함(dMMR, mismatch repair deficient)이 없는 진행성 자궁내막암 치료로서 렌바티닙과의 병용 요법
고빈도 ‑현미부수체 불안정성(MSI ‑H) 암
이전의 치료를 받은 후 진행하였고 만족스러운 대체 치료 옵션이 없는, 고빈도 ‑현미부수체 불안정성(MSI ‑H) 또는 불일치 복구 결함(dMMR)을 나타내며 수술이 불가능하거나 전이성인 자궁내막암, 위암, 소장암, 난소암, 췌장암, 담도암 환자의 치료
고빈도 ‑현미부수체 불안정성(MSI ‑H) 직결장암
고빈도 ‑현미부수체 불안정성(MSI ‑H) 또는 불일치 복구 결함(dMMR)을 나타내며 수술이 불가능하거나 전이성인 직결장암 환자의 치료
삼중음성 유방암
1. 고위험 조기 삼중음성 유방암 환자의 치료로서 수술 전 보조요법(neoadjuvant)으로 항암화학요법과 병용 요법, 그리고 이어서 수술 후 보조요법(adjuvant)으로 단독 요법
2. PD ‑L1 발현 양성(CPS ≧10)이며, 수술이 불가능한 국소 재발성 또는 전이성 삼중음성 유방암 환자의 치료로서 항암화학요법과의 병용 요법
자궁경부암
1. FIGO 2014 III ‑IVA기 자궁경부암 환자의 치료로서 화학방사선요법과의 병용 요법
2. PD ‑L1 발현 양성(CPS ≧1)이며 지속성, 재발성 또는 전이성 자궁경부암 환자의 치료로서 베바시주맙을 포함하거나 포함하지 않는 항암화학요법과의 병용 요법
담도암
수술이 불가능한 국소 진행성 또는 전이성 담도암 환자의 1차 치료로서 젬시타빈 및 시스플라틴과의 병용 요법
간세포암
이전에 PD ‑1/PD ‑L1 요법을 제외한 전신 요법으로 치료 받은 B형 간염 관련 간세포암 환자의 치료
용법 · 용량
환자선택
단독 요법
◦진행성 비소세포폐암
◦전이성 또는 수술이 불가능한 재발성 두경부 편평상피세포암
병용요법
◦수술이 불가능한 국소 재발성 또는 전이성 삼중음성 유방암
◦수술이 불가능한 국소 진행성 또는 전이성 HER2 양성 위 또는 위식도접합부 선암
◦수술이 불가능한 국소 진행성 또는 전이성 식도암이나 HER‑2 음성인 위식도 접합부 선암(병변의 중심(epicenter)이 위식도 접합부 1‑5cm위에 위치)
◦지속성, 재발성 또는 전이성 자궁경부암
PD‑L1 양성 진단 시험은 식품의약품안전처에서 동 의약품의 사용에 적합하게 허가된 체외진단용 의료기기를 사용하여 평가한다.
이 약을 다음의 환자에게 투여하고자 하는 경우, 고빈도‑현미부수체 불안정성(MSI ‑H, microsatellite instability high) 또는 불일치 복구 결함(dMMR, mismatch repair deficient) 종양 상태인 경우에만 투여한다(14. 임상시험 정보 항 참고).
◦이전의 치료를 받은 후 진행한 암(자궁내막암, 위암, 소장암, 난소암, 췌장암 및 담도암)
◦수술이 불가능하거나 전이성인 직결장암
권장용량
이 약을 30분에 걸쳐 정맥 점적주입한다.
이 약의 성인 권장용량은 다음 중 하나를 따른다:
◦200 mg을 매 3주마다 투여 또는
◦400 mg을 매 6주마다 투여
전형적 호지킨 림프종 소아 환자에서 이 약의 권장용량은 2 mg/kg (최대 200 mg)이며, 매 3주마다 30분 동안 정맥 점적주입한다.
병용요법으로 투여하기 위해서는 해당 병용 약제의 처방정보를 참고한다. (사용상의 주의사항 14. 임상시험 정보 항 참고) 이 약을 정맥주사용 화학요법제와 병용하여 투여하는 경우 이 약이 먼저 투여되어야 한다.
이 약과 엔포투맙베도틴을 병용 투여하는 요로상피암 환자에서 같은 날 병용 투여하는 경우, 이 약을 엔포투맙베도틴 다음으로 투여하여야 한다.
이 약과 엔포투맙베도틴을 병용 투여하는 요로상피암 환자에서 엔포투맙베도틴의 권장 초회 용량은 1.25mg/kg (≧100kg 환자에서 최대 125mg)으로 21일 주기의 1일차와 8일차에 정맥 투여하며, 질병의 진행 또는 허용 불가능한 독성 발생 전까지 투여한다.
이 약과 엑시티닙을 병용 투여하는 신세포암 환자는 엑시티닙의 용법용량과 관련된 허가사항을 참고한다. 이 약과 병용하여 사용될 때, 엑시티닙은 6주 이상의 간격으로 초기 투여용량인 5 mg을 초과하는 용량으로의 증량이 고려될 수 있다.
이 약과 렌바티닙을 병용 투여하는 자궁내막암 및 신세포암 환자에서 렌바티닙의 권장 투여 용량은 1일 1회 20mg 경구 투여이며, 렌바티닙의 권장 용량 정보는 렌바티닙의 허가사항을 참고한다.
이 약은 질환이 진행되거나 허용 불가능한 독성 발생 전까지 투여한다.
이 약은 긴급 상황에 대응 가능한 의료시설에서 항암치료요법에 대한 지식과 경험이 충분한 의사에 의해 투여되어야 한다.
흑색종, 비소세포폐암 또는 신세포암의 수술 후 보조요법(adjuvant) 치료 시, 이 약은 최대 1년까지 혹은 질환이 재발하거나 허용 불가능한 독성 발생 전까지 투여한다.
절제 가능한 비소세포폐암의 수술 전 보조요법(neoadjuvant) 및 수술 후 보조요법(adjuvant) 치료 시, 수술 전 보조요법으로서 이 약을 항암화학요법과 병용하여 12주 동안 또는 근치적 수술을 불가능하게 하는 질병 진행이나 허용 불가능한 독성 발생 전까지 투여하고, 이어서 수술 후 보조요법으로서 이 약을 단독으로 39주 동안 또는 질병 재발이나 허용 불가능한 독성 발생 전까지 투여한다.
고위험 조기 삼중음성 유방암
수술 전 보조요법(neoadjuvant): 이 약을 항암화학요법과 병용하여 매 3주마다 200 mg 8회 또는 매 6주마다 400 mg 4회 투여한다.
수술 후 보조요법(adjuvant): 이 약을 단독으로 매 3주마다 200 mg 9회 또는 매 6주마다 400 mg 5회 투여한다.
수술 전 보조요법(neoadjuvant) 및 수술 후 보조요법(adjuvant) 치료 시, 질병의 진행 또는 이 약과 관련된 허용 불가능한 독성을 경험한 경우 이 약의 투여를 중단한다.
용량조절
이 약의 용량감량은 권장되지 않는다. 표 1에 기재된 약물이상반응을 관리하기 위해서는 이 약을 보류하거나 중단한다.
표 1. 용량 조절 권장사항 (사용상의 주의사항 4. 일반적 주의 항 참고)
|
약물이상반응 |
중증도 |
용량 조절 |
|
면역-매개 폐염증 |
중등증(2등급) |
0~1등급으로 회복될 때까지 이 약의 투여를 보류한다.* |
|
중증 또는 생명을 위협하는(3등급 또는 4등급), 또는 재발성 중등증(2등급) |
이 약의 투여를 영구 중단한다. | |
|
면역-매개 결장염 |
중등증 또는 중증(2등급 또는 3등급) |
0~1등급으로 회복될 때까지 이 약의 투여를 보류한다.* |
|
생명을 위협하는(4등급), 또는 재발성 중증(3등급) |
이 약의 투여를 영구 중단한다. | |
|
면역-매개 신장염 |
중등증(2등급) |
0~1등급으로 회복될 때까지 이 약의 투여를 보류한다.* |
|
중증 또는 생명을 위협하는(3등급 또는 4등급) |
이 약의 투여를 영구 중단한다. | |
|
면역-매개 내분비병증 |
중증 또는 생명을 위협하는(3등급 또는 4등급) |
0~1등급으로 회복될 때까지 이 약의 투여를 보류한다.*
2등급 이하로 개선되거나 호르몬 대체 요법으로 조절되는 중증(3등급) 또는 생명을 위협하는(4등급) 내분비병증의 경우, 이 약 투여를 지속하는 것을 고려할 수 있다. |
|
면역-매개 간염/비-간세포암(non-HCC)
엑시티닙과의 병용요법으로 투여받는 신세포암 환자에서의 간 효소 상승의 경우, 표 아래쪽의 용량 조절 지침을 참고한다. |
아스파라긴산 아미노전이효소(AST) 또는 알라닌 아미노전이효소(ALT)가 정상 상한치(ULN)의 3배 초과~5배로 상승하거나 총 빌리루빈이 정상 상한치의 1.5배 초과~3배로 상승하는 경우 |
0~1등급으로 회복될 때까지 이 약의 투여를 보류한다.* |
|
AST 또는 ALT가 정상 상한치의 5배를 초과하거나 총 빌리루빈이 정상 상한치의 3배를 초과하는 경우 |
이 약의 투여를 영구 중단한다. | |
|
AST 또는 ALT의 중등도(2등급) 상승이 있는 상태에서 치료를 시작한 간 전이 환자에서 AST 또는 ALT 상승이 기저치 대비 50% 이상이고 지속 기간이 1주 이상인 경우 |
이 약의 투여를 영구 중단한다. | |
|
면역-매개 간염/간세포암 (HCC)
|
AST 또는 ALT의 기저치가 정상 상한치의 2배 미만이고, AST 또는 ALT가 정상 상한치의 5배 이상으로 증가하는 경우; AST 또는 ALT의 기저치가 정상 상한치의 2배 이상이고, AST 또는 ALT가 기저치의 3배를 초과하는 경우; 또는 기저치에 관계 없이 AST 또는 ALT>500U/L인 경우
총 빌리루빈의 기저치가 1.5mg/dL를 넘지 않고, 총 빌리루빈이 2mg/dL를 초과하는 경우; 총 빌리루빈의 기저치가 1.5mg/dL이상이고, 총 빌리루빈이 기저치의 2배 이상으로 증가하는 경우; 또는 기저치에 관계 없이 총 빌리루빈이 3.0mg/dL를 초과하는 경우
|
0~1등급으로 회복될 때까지 이 약의 투여를 보류한다.*
|
|
ALT가 정상 상한치의 20배를 초과하는 경우; Child Pugh 점수가 9점 이상인 경우; 문맥 고혈압을 암시하는 위장관계 출혈; 복수; 또는 간성 뇌 병증 |
이 약의 투여를 영구 중단한다. | |
|
면역-매개 피부반응 또는 스티븐스-존슨 증후군(SJS) 또는 독성 표피괴사융해증 (TEN) |
중증 피부반응(3등급)이 나타나거나 스티븐스-존슨 증후군(SJS) 또는 독성표피괴사융해증(TEN)이 의심되는 경우 |
0~1등급으로 회복될 때까지 이 약의 투여를 보류한다.* |
|
중증 피부반응(4등급)이 나타나거나 스티븐스-존슨 증후군(SJS) 또는 독성표피괴사융해증(TEN)이 확진된 경우 |
이 약의 투여를 영구 중단한다. | |
|
기타 면역-매개 약물이상반응 |
중증도와 이상사례의 유형에 따라 (2등급 또는 3등급) |
0~1등급으로 회복될 때까지 이 약의 투여를 보류한다.* |
|
중증 또는 생명을 위협하는 (3등급 또는 4등급) 심근염, 뇌염, 또는 길랑-바레증후군 |
이 약의 투여를 영구 중단한다. | |
|
생명을 위협하거나(4등급) 재발성 중증(3등급) |
이 약의 투여를 영구 중단한다. | |
|
주입 관련 반응 |
중증 또는 생명을 위협하는 (3등급 또는 4등급) |
이 약의 투여를 영구 중단한다. |
|
주의: 독성 등급은 NCI CTCAE v4.0(National Cancer Institute Common Terminology Criteria for Adverse Events Version 4.0)에 따른다. * 12주 이내에 코르티코스테로이드 용량을 프레드니손 해당량으로 1일 10 mg 이하로 감량할 수 없는 경우이거나 이 약 최종 투여 후 12주 이내에 치료-관련 독성이 0~1등급으로 회복되지 않는 경우에는 이 약의 투여를 영구 중단한다. | ||
이 약과 엑시티닙의 병용 요법으로 투여받는 신세포암 환자:
▪ALT 또는 AST가 정상 상한치의 3배 이상~10배 미만이면서 동시에 총 빌리루빈이 정상 상한치의 2배 이상으로 상승하지 않는 경우, 이상사례가 0~1등급으로 회복될 때까지 이 약과 엑시티닙의 투여를 모두 보류한다. 코르티코스테로이드 투여를 고려한다. 회복 후에는 한 가지 약으로 재투여하거나, 두 가지 약을 순차적으로 재투여하는 것을 고려한다. 엑시티닙을 재투여하는 경우, 엑시티닙의 허가사항에 따라 용량 감량을 고려한다.
▪ALT 또는 AST가 정상 상한치의 10배 이상인 경우, 또는 정상 상한치의 3배 초과이면서 동시에 총 빌리루빈이 정상 상한치의 2배 이상으로 상승하는 경우, 이 약과 엑시티닙의 투여를 모두 영구 중단하고 코르티코스테로이드 투여를 고려한다.
이 약과 렌바티닙을 병용 투여하는 경우, 약물이상반응을 적절히 조절하기 위해 한 가지 또는 두 가지 약을 일시 중단하거나 렌바티닙의 용량을 감량하거나, 중단한다. 렌바티닙의 약물이상반응 조절을 위한 권장사항은 렌바티닙의 허가사항을 참고한다. 이 약의 용량감량은 권장되지 않는다.
사용상의 주의사항
복약정보
1. 수술이 불가능하거나 전이성인 흑색종 환자의 치료
2. 완전 절제술을 받은 IIB기, IIC기 또는 III기 흑색종 환자의 수술 후 보조요법(adjuvant) 치료
비소세포폐암
1. EGFR 또는 ALK 변이가 없는 전이성 비편평 비소세포폐암 환자에서의 1차 치료로서 페메트렉시드 및 백금 화학요법과의 병용 요법
2. 전이성 편평 비소세포폐암 환자에서의 1차 치료로서 카보플라틴 및 파클리탁셀(혹은 알부민 결합 파클리탁셀)과의 병용 요법
3. PD ‑L1 발현 양성(Tumor Proportion Score(TPS) ≧50%)으로서, EGFR 또는 ALK 변이가 없는 진행성 비소세포폐암 환자에서의 1차 치료
4. PD ‑L1 발현 양성(TPS ≧1%)으로서, 백금 기반 화학요법제 치료 도중 또는 이후에 진행이 확인된 진행성 비소세포폐암의 치료. 다만 EGFR 또는 ALK 변이가 확인된 환자는 이 약을 투여하기 전에 이러한 변이에 대한 승인된 치료제를 투여한 후에도 질병의 진행이 확인된 경우여야 한다.
5. 절제 가능한(종양 크기 4 cm 이상 또는 양성 림프절) 비소세포폐암 환자의 치료로서 수술 전 보조요법(neoadjuvant)으로 백금 기반 항암화학요법과 병용 요법, 그리고 이어서 수술 후 보조요법(adjuvant)으로 단독 요법
6. 절제술과 백금 기반 화학요법제 치료를 받은 IB기(T2a ≧ 4cm), II기 또는 IIIA기 비소세포폐암 환자에서의 수술 후 보조요법(adjuvant)으로서 단독 요법
악성 흉막 중피종
수술이 불가능한 진행성 또는 전이성 악성 흉막 중피종 환자의 1차 치료로서 페메트렉시드 및 백금 화학요법과의 병용 요법
두경부암
1. 전이성 또는 수술이 불가능한 재발성 두경부 편평상피세포암 환자에서의 1차 치료로서
◦ PD ‑L1 발현 양성(Combined Positive Score (CPS) ≧1)인 환자에서의 단독 요법
◦ 백금 및 플루오로우라실(5 ‑FU) 화학요법과의 병용 요법2. PD ‑L1 발현 양성(TPS ≧50%)으로서, 백금 기반 화학요법제 치료 도중 또는 이후에 진행이 확인된 전이성 또는 수술이 불가능한 재발성 두경부 편평상피세포암의 치료로서 단독 요법
전형적 호지킨 림프종
자가조혈모세포이식에 실패하거나, 자가조혈모세포이식이 치료 옵션이 아닌 경우 최소 두 가지 이상의 이전 요법에 실패한 재발성 또는 불응성인 전형적 호지킨 림프종 성인 및 2세 이상의 소아 환자의 치료
요로상피암
1. 국소 진행성 또는 전이성 요로상피암 환자의 1차 치료로서 엔포투맙베도틴과의 병용 요법
2. 백금 기반 항암화학요법이 불가능한 국소 진행성 또는 전이성 요로상피암의 치료
3. 백금 기반 화학요법제 치료 도중 또는 이후에 진행이 확인되거나, 백금기반의 수술 전 보조요법(neoadjuvant) 또는 수술 후 보조요법(adjuvant) 치료 12개월 이내에 진행이 확인된 국소 진행성 또는 전이성인 요로상피암의 치료
4. 방광 절제술이 불가능하거나 시행을 선택하지 않았으며, 유두종 유무에 상관없이 상피내암을 동반한 BCG ‑불응 고위험 비근침습성 방광암의 치료
위암
1. PD ‑L1 발현 양성(CPS ≧1)으로서, 수술이 불가능한 국소 진행성 또는 전이성 HER2 양성 위 또는 위식도접합부 선암 환자에서의 1차 치료로서 트라스투주맙과 플루오로피리미딘 및 백금 화학요법과의 병용 요법
2. 수술이 불가능한 국소 진행성 또는 전이성 HER2 음성 위 또는 위식도접합부 선암 환자에서의 1차 치료로서 플루오로피리미딘 및 백금 기반 화학요법과의 병용 요법
식도암
PD ‑L1 발현 양성(CPS ≧10)으로서, 수술이 불가능한 국소 진행성 또는 전이성 식도암이나 HER ‑2 음성인 위식도 접합부 선암(병변의 중심(epicenter)이 위식도 접합부 1 ‑5cm위에 위치) 환자에서의 1차 치료로서 백금 및 플루오로피리미딘 기반 화학요법과의 병용 요법
신세포암
1. 진행성 신세포암 환자에서의 1차 치료로서 엑시티닙과의 병용 요법
2. 진행성 신세포암 환자에서의 1차 치료로서 렌바티닙과의 병용 요법
3. 신장 절제술 이후 재발 위험이 중등 ‑고위험 또는 고위험이거나 신장 절제술 및 전이 병변 절제 이후인 신세포암 환자의 수술 후 보조요법(adjuvant) 치료로서 단독 요법 (사용상의 주의사항 14. 임상시험 정보항 참고)
자궁내막암
1. 새로 진단된 진행성 또는 재발성 자궁내막암 환자의 치료로서 카보플라틴 및 파클리탁셀과의 병용 요법
2. 이전의 전신 요법 이후 진행이 확인되고 수술적 치료 또는 방사선 치료가 부적합한, 고빈도 ‑현미부수체 불안정성(MSI ‑H, microsatellite instability high) 또는 불일치 복구 결함(dMMR, mismatch repair deficient)이 없는 진행성 자궁내막암 치료로서 렌바티닙과의 병용 요법
고빈도 ‑현미부수체 불안정성(MSI ‑H) 암
이전의 치료를 받은 후 진행하였고 만족스러운 대체 치료 옵션이 없는, 고빈도 ‑현미부수체 불안정성(MSI ‑H) 또는 불일치 복구 결함(dMMR)을 나타내며 수술이 불가능하거나 전이성인 자궁내막암, 위암, 소장암, 난소암, 췌장암, 담도암 환자의 치료
고빈도 ‑현미부수체 불안정성(MSI ‑H) 직결장암
고빈도 ‑현미부수체 불안정성(MSI ‑H) 또는 불일치 복구 결함(dMMR)을 나타내며 수술이 불가능하거나 전이성인 직결장암 환자의 치료
삼중음성 유방암
1. 고위험 조기 삼중음성 유방암 환자의 치료로서 수술 전 보조요법(neoadjuvant)으로 항암화학요법과 병용 요법, 그리고 이어서 수술 후 보조요법(adjuvant)으로 단독 요법
2. PD ‑L1 발현 양성(CPS ≧10)이며, 수술이 불가능한 국소 재발성 또는 전이성 삼중음성 유방암 환자의 치료로서 항암화학요법과의 병용 요법
자궁경부암
1. FIGO 2014 III ‑IVA기 자궁경부암 환자의 치료로서 화학방사선요법과의 병용 요법
2. PD ‑L1 발현 양성(CPS ≧1)이며 지속성, 재발성 또는 전이성 자궁경부암 환자의 치료로서 베바시주맙을 포함하거나 포함하지 않는 항암화학요법과의 병용 요법
담도암
수술이 불가능한 국소 진행성 또는 전이성 담도암 환자의 1차 치료로서 젬시타빈 및 시스플라틴과의 병용 요법
간세포암
이전에 PD ‑1/PD ‑L1 요법을 제외한 전신 요법으로 치료 받은 B형 간염 관련 간세포암 환자의 치료
이 약을 다음의 환자에게 투여하고자 하는 경우, PD ‑L1 발현이 양성인 경우에만 투여한다.
단독 요법
◦진행성 비소세포폐암
◦전이성 또는 수술이 불가능한 재발성 두경부 편평상피세포암
병용요법
◦수술이 불가능한 국소 재발성 또는 전이성 삼중음성 유방암
◦수술이 불가능한 국소 진행성 또는 전이성 HER2 양성 위 또는 위식도접합부 선암
◦수술이 불가능한 국소 진행성 또는 전이성 식도암이나 HER‑2 음성인 위식도 접합부 선암(병변의 중심(epicenter)이 위식도 접합부 1‑5cm위에 위치)
◦지속성, 재발성 또는 전이성 자궁경부암
PD‑L1 양성 진단 시험은 식품의약품안전처에서 동 의약품의 사용에 적합하게 허가된 체외진단용 의료기기를 사용하여 평가한다.
이 약을 다음의 환자에게 투여하고자 하는 경우, 고빈도‑현미부수체 불안정성(MSI ‑H, microsatellite instability high) 또는 불일치 복구 결함(dMMR, mismatch repair deficient) 종양 상태인 경우에만 투여한다(14. 임상시험 정보 항 참고).
◦이전의 치료를 받은 후 진행한 암(자궁내막암, 위암, 소장암, 난소암, 췌장암 및 담도암)
◦수술이 불가능하거나 전이성인 직결장암
권장용량
이 약을 30분에 걸쳐 정맥 점적주입한다.
이 약의 성인 권장용량은 다음 중 하나를 따른다:
◦200 mg을 매 3주마다 투여 또는
◦400 mg을 매 6주마다 투여
전형적 호지킨 림프종 소아 환자에서 이 약의 권장용량은 2 mg/kg (최대 200 mg)이며, 매 3주마다 30분 동안 정맥 점적주입한다.
병용요법으로 투여하기 위해서는 해당 병용 약제의 처방정보를 참고한다. (사용상의 주의사항 14. 임상시험 정보 항 참고) 이 약을 정맥주사용 화학요법제와 병용하여 투여하는 경우 이 약이 먼저 투여되어야 한다.
이 약과 엔포투맙베도틴을 병용 투여하는 요로상피암 환자에서 같은 날 병용 투여하는 경우, 이 약을 엔포투맙베도틴 다음으로 투여하여야 한다.
이 약과 엔포투맙베도틴을 병용 투여하는 요로상피암 환자에서 엔포투맙베도틴의 권장 초회 용량은 1.25mg/kg (≧100kg 환자에서 최대 125mg)으로 21일 주기의 1일차와 8일차에 정맥 투여하며, 질병의 진행 또는 허용 불가능한 독성 발생 전까지 투여한다.
이 약과 엑시티닙을 병용 투여하는 신세포암 환자는 엑시티닙의 용법용량과 관련된 허가사항을 참고한다. 이 약과 병용하여 사용될 때, 엑시티닙은 6주 이상의 간격으로 초기 투여용량인 5 mg을 초과하는 용량으로의 증량이 고려될 수 있다.
이 약과 렌바티닙을 병용 투여하는 자궁내막암 및 신세포암 환자에서 렌바티닙의 권장 투여 용량은 1일 1회 20mg 경구 투여이며, 렌바티닙의 권장 용량 정보는 렌바티닙의 허가사항을 참고한다.
이 약은 질환이 진행되거나 허용 불가능한 독성 발생 전까지 투여한다.
이 약은 긴급 상황에 대응 가능한 의료시설에서 항암치료요법에 대한 지식과 경험이 충분한 의사에 의해 투여되어야 한다.
흑색종, 비소세포폐암 또는 신세포암의 수술 후 보조요법(adjuvant) 치료 시, 이 약은 최대 1년까지 혹은 질환이 재발하거나 허용 불가능한 독성 발생 전까지 투여한다.
절제 가능한 비소세포폐암의 수술 전 보조요법(neoadjuvant) 및 수술 후 보조요법(adjuvant) 치료 시, 수술 전 보조요법으로서 이 약을 항암화학요법과 병용하여 12주 동안 또는 근치적 수술을 불가능하게 하는 질병 진행이나 허용 불가능한 독성 발생 전까지 투여하고, 이어서 수술 후 보조요법으로서 이 약을 단독으로 39주 동안 또는 질병 재발이나 허용 불가능한 독성 발생 전까지 투여한다.
고위험 조기 삼중음성 유방암
수술 전 보조요법(neoadjuvant): 이 약을 항암화학요법과 병용하여 매 3주마다 200 mg 8회 또는 매 6주마다 400 mg 4회 투여한다.
수술 후 보조요법(adjuvant): 이 약을 단독으로 매 3주마다 200 mg 9회 또는 매 6주마다 400 mg 5회 투여한다.
수술 전 보조요법(neoadjuvant) 및 수술 후 보조요법(adjuvant) 치료 시, 질병의 진행 또는 이 약과 관련된 허용 불가능한 독성을 경험한 경우 이 약의 투여를 중단한다.
용량조절
이 약의 용량감량은 권장되지 않는다. 표 1에 기재된 약물이상반응을 관리하기 위해서는 이 약을 보류하거나 중단한다.
표 1. 용량 조절 권장사항 (사용상의 주의사항 4. 일반적 주의 항 참고)
|
약물이상반응 |
중증도 |
용량 조절 |
|
면역-매개 폐염증 |
중등증(2등급) |
0~1등급으로 회복될 때까지 이 약의 투여를 보류한다.* |
|
중증 또는 생명을 위협하는(3등급 또는 4등급), 또는 재발성 중등증(2등급) |
이 약의 투여를 영구 중단한다. | |
|
면역-매개 결장염 |
중등증 또는 중증(2등급 또는 3등급) |
0~1등급으로 회복될 때까지 이 약의 투여를 보류한다.* |
|
생명을 위협하는(4등급), 또는 재발성 중증(3등급) |
이 약의 투여를 영구 중단한다. | |
|
면역-매개 신장염 |
중등증(2등급) |
0~1등급으로 회복될 때까지 이 약의 투여를 보류한다.* |
|
중증 또는 생명을 위협하는(3등급 또는 4등급) |
이 약의 투여를 영구 중단한다. | |
|
면역-매개 내분비병증 |
중증 또는 생명을 위협하는(3등급 또는 4등급) |
0~1등급으로 회복될 때까지 이 약의 투여를 보류한다.*
2등급 이하로 개선되거나 호르몬 대체 요법으로 조절되는 중증(3등급) 또는 생명을 위협하는(4등급) 내분비병증의 경우, 이 약 투여를 지속하는 것을 고려할 수 있다. |
|
면역-매개 간염/비-간세포암(non-HCC)
엑시티닙과의 병용요법으로 투여받는 신세포암 환자에서의 간 효소 상승의 경우, 표 아래쪽의 용량 조절 지침을 참고한다. |
아스파라긴산 아미노전이효소(AST) 또는 알라닌 아미노전이효소(ALT)가 정상 상한치(ULN)의 3배 초과~5배로 상승하거나 총 빌리루빈이 정상 상한치의 1.5배 초과~3배로 상승하는 경우 |
0~1등급으로 회복될 때까지 이 약의 투여를 보류한다.* |
|
AST 또는 ALT가 정상 상한치의 5배를 초과하거나 총 빌리루빈이 정상 상한치의 3배를 초과하는 경우 |
이 약의 투여를 영구 중단한다. | |
|
AST 또는 ALT의 중등도(2등급) 상승이 있는 상태에서 치료를 시작한 간 전이 환자에서 AST 또는 ALT 상승이 기저치 대비 50% 이상이고 지속 기간이 1주 이상인 경우 |
이 약의 투여를 영구 중단한다. | |
|
면역-매개 간염/간세포암 (HCC)
|
AST 또는 ALT의 기저치가 정상 상한치의 2배 미만이고, AST 또는 ALT가 정상 상한치의 5배 이상으로 증가하는 경우; AST 또는 ALT의 기저치가 정상 상한치의 2배 이상이고, AST 또는 ALT가 기저치의 3배를 초과하는 경우; 또는 기저치에 관계 없이 AST 또는 ALT>500U/L인 경우
총 빌리루빈의 기저치가 1.5mg/dL를 넘지 않고, 총 빌리루빈이 2mg/dL를 초과하는 경우; 총 빌리루빈의 기저치가 1.5mg/dL이상이고, 총 빌리루빈이 기저치의 2배 이상으로 증가하는 경우; 또는 기저치에 관계 없이 총 빌리루빈이 3.0mg/dL를 초과하는 경우
|
0~1등급으로 회복될 때까지 이 약의 투여를 보류한다.*
|
|
ALT가 정상 상한치의 20배를 초과하는 경우; Child Pugh 점수가 9점 이상인 경우; 문맥 고혈압을 암시하는 위장관계 출혈; 복수; 또는 간성 뇌 병증 |
이 약의 투여를 영구 중단한다. | |
|
면역-매개 피부반응 또는 스티븐스-존슨 증후군(SJS) 또는 독성 표피괴사융해증 (TEN) |
중증 피부반응(3등급)이 나타나거나 스티븐스-존슨 증후군(SJS) 또는 독성표피괴사융해증(TEN)이 의심되는 경우 |
0~1등급으로 회복될 때까지 이 약의 투여를 보류한다.* |
|
중증 피부반응(4등급)이 나타나거나 스티븐스-존슨 증후군(SJS) 또는 독성표피괴사융해증(TEN)이 확진된 경우 |
이 약의 투여를 영구 중단한다. | |
|
기타 면역-매개 약물이상반응 |
중증도와 이상사례의 유형에 따라 (2등급 또는 3등급) |
0~1등급으로 회복될 때까지 이 약의 투여를 보류한다.* |
|
중증 또는 생명을 위협하는 (3등급 또는 4등급) 심근염, 뇌염, 또는 길랑-바레증후군 |
이 약의 투여를 영구 중단한다. | |
|
생명을 위협하거나(4등급) 재발성 중증(3등급) |
이 약의 투여를 영구 중단한다. | |
|
주입 관련 반응 |
중증 또는 생명을 위협하는 (3등급 또는 4등급) |
이 약의 투여를 영구 중단한다. |
|
주의: 독성 등급은 NCI CTCAE v4.0(National Cancer Institute Common Terminology Criteria for Adverse Events Version 4.0)에 따른다. * 12주 이내에 코르티코스테로이드 용량을 프레드니손 해당량으로 1일 10 mg 이하로 감량할 수 없는 경우이거나 이 약 최종 투여 후 12주 이내에 치료-관련 독성이 0~1등급으로 회복되지 않는 경우에는 이 약의 투여를 영구 중단한다. | ||
이 약과 엑시티닙의 병용 요법으로 투여받는 신세포암 환자:
▪ALT 또는 AST가 정상 상한치의 3배 이상~10배 미만이면서 동시에 총 빌리루빈이 정상 상한치의 2배 이상으로 상승하지 않는 경우, 이상사례가 0~1등급으로 회복될 때까지 이 약과 엑시티닙의 투여를 모두 보류한다. 코르티코스테로이드 투여를 고려한다. 회복 후에는 한 가지 약으로 재투여하거나, 두 가지 약을 순차적으로 재투여하는 것을 고려한다. 엑시티닙을 재투여하는 경우, 엑시티닙의 허가사항에 따라 용량 감량을 고려한다.
▪ALT 또는 AST가 정상 상한치의 10배 이상인 경우, 또는 정상 상한치의 3배 초과이면서 동시에 총 빌리루빈이 정상 상한치의 2배 이상으로 상승하는 경우, 이 약과 엑시티닙의 투여를 모두 영구 중단하고 코르티코스테로이드 투여를 고려한다.
이 약과 렌바티닙을 병용 투여하는 경우, 약물이상반응을 적절히 조절하기 위해 한 가지 또는 두 가지 약을 일시 중단하거나 렌바티닙의 용량을 감량하거나, 중단한다. 렌바티닙의 약물이상반응 조절을 위한 권장사항은 렌바티닙의 허가사항을 참고한다. 이 약의 용량감량은 권장되지 않는다.
이 약 및 그 구성 성분에 과민증인 환자
2. 다음 환자에는 신중히 투여할 것
자가면역질환이 있거나 만성적 혹은 재발성 자가면역질환의 기왕력이 있는 환자
3. 이상사례
1) 임상시험에서 보고된 이상사례
대조 및 비대조 임상시험에서 총 2799명을 대상으로 이 약의 안전성을 분석하였다. 치료 기간의 중앙값은 4.2개월(범위 : 1일 ~ 30.4개월)이었고, 6개월 이상 치료받은 환자는 1153명, 1년 이상 치료 받은 환자는 600명이었다.
환자의 5%가 치료 관련 약물이상반응으로 이 약 투여를 중단하였다. 최종 투여 후 90일째까지 보고된 치료 관련 중대한 이상사례(SAE)는 이 약을 투여 받은 환자의 10%에서 발생하였다. 발생한 치료 관련 중대한 이상사례 중 가장 흔하게 발생한 이상사례는 다음과 같다; 폐염증, 결장염, 설사, 발열. 치료 관련 중대한 이상사례로 자가면역성 간염과 부신기능저하증도 보고되었다.
가. 흑색종
표 2는 KEYNOTE ‑006에서 흑색종 환자에게 이 약을 투여했을 때 10% 이상의 환자에서 보고된 이상사례를 요약한 것이다. 가장 흔한 이상사례(20% 이상의 환자에서 보고됨)는 피로와 설사였다.
표 2. 흑색종 환자에게 이 약을 투여했을 때 10% 이상의 환자에서 보고되고 이필리무맙 투여군 이상으로 발생한 이상사례 (KEYNOTE ‑006)
|
|
이 약 10 mg/kg 매 2주 또는 3주에 1회 n=555 |
이필리무맙 3 mg/kg 매 3주에 1회 n=256 | ||
|
이상사례 |
모든 등급† (%) |
3-4등급 (%) |
모든 등급 (%) |
3-4등급 (%) |
|
전신 장애 및 투여부위 상태 | ||||
|
피로 |
28 |
0.9 |
28 |
3.1 |
|
피부 및 피하조직 장애 | ||||
|
발진‡ |
24 |
0.2 |
23 |
1.2 |
|
백반증§ |
13 |
0 |
2 |
0 |
|
근골격계 및 결합조직 장애 | ||||
|
관절통 |
18 |
0.4 |
10 |
1.2 |
|
등허리 통증 |
12 |
0.9 |
7 |
0.8 |
|
호흡기, 흉부 및 종격동 장애 | ||||
|
기침 |
17 |
0 |
7 |
0.4 |
|
호흡곤란 |
11 |
0.9 |
7 |
0.8 |
|
대사 및 영양 장애 | ||||
|
식욕 감퇴 |
16 |
0.5 |
14 |
0.8 |
|
신경계 장애 | ||||
|
두통 |
14 |
0.2 |
14 |
0.8 |
|
†NCI CTCAE v4.0에 따라 등급을 매겼다. ‡발진, 홍반성 발진, 수포성 발진, 전신발진, 황반성 발진, 반상-구진 발진, 구진성 발진, 소양성 발진, 박리성 발진을 포함한다. §피부 저색소침착을 포함한다. | ||||
표 3. 이 약을 투여한 흑색종 환자의 20% 이상에서 발생한 기저치보다 악화된 임상검사치 이상 중 이필리무맙군 이상으로 많이 발생한 이상 (KEYNOTE ‑006)
|
|
이 약 10 mg/kg 매 2주 또는 3주에 1회 |
이필리무맙 | ||
|
임상검사† |
모든 등급 (%)‡ |
3-4등급 (%) |
모든 등급 (%) |
3-4등급 (%) |
|
화학적 검사 | ||||
|
고혈당증 |
45 |
4.2 |
45 |
3.8 |
|
고중성지방혈증 |
43 |
2.6 |
31 |
1.1 |
|
저나트륨혈증 |
28 |
4.6 |
26 |
7 |
|
AST 증가 |
27 |
2.6 |
25 |
2.5 |
|
고콜레스테롤혈증 |
20 |
1.2 |
13 |
0 |
|
혈액학적 검사 | ||||
|
빈혈 |
35 |
3.8 |
33 |
4.0 |
|
림프구감소증 |
33 |
7 |
25 |
6 |
|
†시험 기저치가 확인되고 최소 1회 이상 임상검사치 측정이 가능했던 환자에 대해 각 시험별 발생률을 계산하였다: 이 약(520-546명) 및 이필리무맙(237-247명); 고중성지방혈증: 이 약 n=429, 이필리무맙 n=183; 고콜레스테롤혈증: 이 약 n=484, 이필리무맙 n=205. ‡NCI CTCAE v4.0에 따라 등급을 매겼다. | ||||
표 4는 KEYNOTE ‑002에서 흑색종 환자에게 이 약을 투여했을 때 10% 이상의 환자에서 보고된 이상사례를 요약한 것이다. 가장 흔한 이상사례(20% 이상의 환자에서 보고됨)는 피로, 소양증, 발진, 변비, 오심, 설사, 식욕감퇴였다.
표 4. 흑색종 환자에게 이 약을 투여했을 때 10% 이상의 환자에서 보고되고 화학요법제 투여군 이상으로 발생한 이상사례 (KEYNOTE ‑002)
|
|
이 약 2 mg/kg 또는 10mg/kg 매 3주에 1회 n=357 |
화학요법제† n=171 | ||
|
이상사례 |
모든 등급‡ (%) |
3-4 등급 (%) |
모든 등급 (%) |
3-4 등급 (%) |
|
전신 장애 및 투여부위 상태 | ||||
|
발열 |
14 |
0.3 |
9 |
0.6 |
|
무력증 |
10 |
2.0 |
9 |
1.8 |
|
피부 및 피하조직 장애 | ||||
|
소양증 |
28 |
0 |
8 |
0 |
|
발진§ |
24 |
0.6 |
8 |
0 |
|
위장관 장애 | ||||
|
변비 |
22 |
0.3 |
20 |
2.3 |
|
설사 |
20 |
0.8 |
20 |
2.3 |
|
복통 |
13 |
1.7 |
8 |
1.2 |
|
호흡기, 흉부 및 종격동 장애 | ||||
|
기침 |
18 |
0 |
16 |
0 |
|
근골격계 및 결합조직 장애 | ||||
|
관절통 |
14 |
0.6 |
10 |
1.2 |
|
†화학요법제: 다카르바진, 테모졸로미드, 카보플라틴/파클리탁셀, 파클리탁셀 또는 카보플라틴 ‡NCI CTCAE v4.0에 따라 등급을 매겼다. §발진, 홍반성 발진, 전신발진, 황반성 발진, 반상-구진 발진, 구진성 발진, 소양성 발진을 포함한다. | ||||
표 5. 이 약을 투여한 흑색종 환자의 20% 이상에서 발생한 기저치보다 악화된 임상검사치 이상 중 화학요법제 군 이상으로 많이 발생한 이상 (KEYNOTE ‑002)
|
|
이 약 2 mg/kg 또는 10 mg/kg 매 3주에 1회 |
화학요법제 | ||
|
임상검사† |
모든 등급 (%)‡ |
3-4등급 (%) |
모든 등급 (%) |
3-4등급 (%) |
|
화학적 검사 | ||||
|
고혈당증 |
49 |
6 |
44 |
6 |
|
저알부민혈증 |
37 |
1.9 |
33 |
0.6 |
|
저나트륨혈증 |
37 |
7 |
24 |
3.8 |
|
고중성지방혈증 |
33 |
0 |
32 |
0.9 |
|
ALP 증가 |
26 |
3.1 |
18 |
1.9 |
|
AST 증가 |
24 |
2.2 |
16 |
0.6 |
|
Bicarbonate 감소 |
22 |
0.4 |
13 |
0 |
|
저칼슘혈증 |
21 |
0.3 |
18 |
1.9 |
|
ALT 증가 |
21 |
1.8 |
16 |
0.6 |
|
†시험 기저치가 확인되고 최소 1회 이상 임상검사치 측정이 가능했던 환자에 대해 각 시험별 발생률을 계산하였다: 이 약 (320-325명) 및 화학요법제(154-161명); 고중성지방혈증: 이 약 n=247, 화학요법제 n=116; bicarbonate 감소: 이 약 n=263, 화학요법제 n=123. ‡NCI CTCAE v4.0에 따라 등급을 매겼다. | ||||
전반적으로, 용량 및 이필리무맙 투여경험에 관계없이 안전성 프로파일은 유사하였다.
나. 절제술을 받은 흑색종
KEYNOTE ‑716에 참여한 절제술을 받은 흑색종 환자 969명 및 KEYNOTE ‑054에 참여한 절제술을 받은 흑색종 환자 1019명에서 발생한 이상사례는 수술이 불가능하거나 전이성인 흑색종 혹은 비소세포폐암 환자에서의 이상사례와 전반적으로 비슷하였다.
다. 비소세포폐암
병용 요법
표 6은 KEYNOTE ‑189에 참여해 이 약과 페메트렉시드 및 백금 화학요법제와의 병용 요법으로 치료받은 환자 중 10% 이상에서 보고된 이상사례를 정리한 것이다. KEYNOTE ‑407에 참여해 이 약과 카보플라틴 및 파클리탁셀 혹은 알부민 결합 파클리탁셀과의 병용 요법으로 치료받은 이전 치료 경험이 없는 비소세포폐암 환자에서 보고된 이상사례는 KEYNOTE ‑189에서 보고된 이상사례와 유사하였지만, 다음 이상사례는 예외적으로 KEYNOTE ‑407에서 발생률이 증가하였다 (이 약 + 화학요법제 vs. 위약+ 화학요법제); 탈모(46% vs. 36%), 관절통(21% vs. 14%), 말초신경병증 (21% vs. 16%), 근육통 (13% vs. 13%), 말초 감각 신경병증(12% vs. 13%), 백혈구 수 감소(11% vs. 11%), 불면증(10% vs. 8%) 및 체중 감소(10% vs. 8%).
표 6. 이 약과 페메트렉시드 및 백금 화학요법제를 함께 투여받은 환자 중 10% 이상에서 발생한 이상사례 (KEYNOTE ‑189)
|
|
이 약 + 페메트렉시드 + 백금 화학요법제 n=405 |
위약 + 페메트렉시드 + 백금 화학요법제 n=202 | ||
|
이상사례 |
모든 등급*(%) |
3-4등급(%) |
모든 등급(%) |
3-4등급(%) |
|
위장관 장애 | ||||
|
오심 |
56 |
3.5 |
52 |
3.5 |
|
변비 |
35 |
1.0 |
32 |
0.5 |
|
설사 |
31 |
5 |
21 |
3.0 |
|
구토 |
24 |
3.7 |
23 |
3.0 |
|
전신 장애 | ||||
|
피로† |
56 |
12 |
58 |
6 |
|
발열 |
20 |
0.2 |
15 |
0 |
|
말초 부종 |
19 |
0.2 |
13 |
0 |
|
대사 및 영양장애 | ||||
|
식욕감퇴 |
28 |
1.5 |
30 |
0.5 |
|
피부 및 피하조직 장애 | ||||
|
발진‡ |
25 |
2.0 |
17 |
2.5 |
|
소양증 |
11 |
0 |
10 |
0 |
|
호흡기, 흉부 및 종격동 장애 | ||||
|
기침 |
21 |
0 |
28 |
0 |
|
호흡 곤란 |
21 |
3.7 |
26 |
5 |
|
눈 장애 | ||||
|
눈물분비 증가 |
17 |
0 |
11 |
0 |
|
근골격계 및 결합조직 장애 | ||||
|
등허리 통증 |
13 |
1.2 |
11 |
1.5 |
|
신경계 장애 | ||||
|
어지러움 |
12 |
0.7 |
9 |
0 |
|
두통 |
12 |
0 |
9 |
0 |
|
미각 이상 |
11 |
0.2 |
9 |
0 |
|
감염 및 감염증 | ||||
|
상기도감염 |
10 |
1.2 |
7 |
1.0 |
|
*NCI CTCAE v4.03에 따라 등급을 매겼다. †무력증 및 피로를 포함한다. ‡생식기 발진, 발진, 전신발진, 황반성 발진, 반상-구진 발진, 구진성 발진, 소양성 발진, 농포성 발진을 포함한다. | ||||
표 7. 이 약을 투여한 환자의 20% 이상에서 발생한 기저치보다 악화된 임상검사치 이상 (KEYNOTE ‑189)
|
|
이 약 + 페메트렉시드 + 백금 화학요법제 |
페메트렉시드 + 백금 화학요법제 | ||
|
임상검사* |
모든 등급 (%)† |
3-4 등급 (%) |
모든 등급 (%) |
3-4 등급 (%) |
|
화학적 검사 | ||||
|
고혈당증 |
63 |
9 |
60 |
7 |
|
ALT 증가 |
47 |
3.8 |
42 |
2.6 |
|
AST 증가 |
47 |
2.8 |
40 |
1.0 |
|
저알부민혈증 |
39 |
2.8 |
39 |
1.1 |
|
크레아티닌 증가 |
37 |
4.2 |
25 |
1.0 |
|
저나트륨혈증 |
32 |
7 |
23 |
6 |
|
저인산혈증 |
30 |
10 |
28 |
14 |
|
ALP 증가 |
26 |
1.8 |
29 |
2.1 |
|
저칼슘혈증 |
24 |
2.8 |
17 |
0.5 |
|
고칼륨혈증 |
24 |
2.8 |
19 |
3.1 |
|
저칼륨혈증 |
21 |
5 |
20 |
5 |
|
혈액학적 검사 | ||||
|
빈혈 |
85 |
17 |
81 |
18 |
|
림프구 감소증 |
64 |
22 |
64 |
25 |
|
호중구 감소증 |
48 |
20 |
41 |
19 |
|
혈소판 감소증 |
30 |
12 |
29 |
8 |
|
*시험 기저치가 확인되고 최소 1회 이상 임상검사치 측정이 가능했던 환자에 대해 각 시험별 발생률을 계산하였다: 이 약+페메트렉시드+백금 화학요법제(381-401명) 및 페메트렉시드+백금 화학요법제(184-197명). †NCI CTCAE v4.03에 따라 등급을 매겼다. | ||||
이전에 치료경험이 없고 AJCC 8판에 따른 절제 가능한 II, IIIA 또는 IIIB(N2)기 비소세포폐암 환자에 대해 수술 전 보조요법으로서 백금 기반 항암화학요법과 병용 투여 후 수술, 그리고 이어서 수술 후 보조요법으로서 단독 투여한 이 약의 안전성은 다기관, 무작위 배정(1:1), 이중 맹검, 위약 대조 임상시험인 KEYNOTE ‑671에서 평가되었다.
매 3주마다 이 약 200 mg에 대한 노출기간 중앙값은 10.9개월(범위: 1일 ‑18.6개월)이었다.
이 약을 수술 전 보조요법으로서 백금 기반 항암화학요법과 병용하여 투여 받고, 이어서 수술 후 보조요법으로서 단독으로 투여 받은 절제 가능한 비소세포폐암 환자들에서 발생한 이상사례는, 이 약을 항암화학요법과 병용하여 투여 받은 종양 유형 관련 다른 임상시험들의 환자들에서와 전반적으로 비슷하였다.
KEYNOTE ‑671의 수술 전 보조요법 단계
총 396명의 환자가 수술 전 보조요법으로서 백금 기반 항암화학요법과 병용하여 이 약을 투여 받았으며, 총 399명의 환자가 수술 전 보조요법으로서 백금 기반 항암화학요법과 병용하여 위약을 투여 받았다.
중대한 이상사례는 수술 전 보조요법으로서 이 약을 백금 기반 항암화학요법과 병용하여 투여 받은 환자의 34%에서 발생하였다; 가장 빈번한( ≧2%) 중대한 이상사례는 폐렴(4.8%), 정맥 혈전 색전증(3.3%), 그리고 빈혈(2%)이었다. 치명적인 이상사례는 환자의 1.3%에서 발생하였으며, 원인미상의 사망(0.8%), 패혈증(0.3%), 그리고 면역 ‑매개 폐 질환(0.3%)을 포함하였다.
이상사례로 인한 영구적인 투여중단은 수술 전 보조요법으로서 이 약을 백금 기반 항암화학요법과 병용하여 투여 받은 환자의 18%에서 발생하였다; 영구적인 투여중단을 야기한 가장 빈번한( ≧1%) 이상사례는 급성 신 손상(1.8%), 간질성 폐 질환(1.8%), 빈혈(1.5%), 중성구 감소증(1.5%), 그리고 폐렴(1.3%)이었다.
수술 전 보조요법으로서 이 약을 투여 받은 환자 396명 및 위약을 투여 받은 환자 399명 중 각각 6%(25명) 및 4.3%(17명)는 이상사례로 인해 수술을 받지 않았다. 이 약 투여군에서 수술 취소를 야기한 가장 빈번한( ≧1%) 이상사례는 간질성 폐 질환(1%)이었다.
이 약을 투여 받은 환자 중 수술을 받은 325명의 환자 중에서, 3.1%(10명)는 이상사례로 인해 수술 지연(환자가 수술 전 보조요법을 4주기 미만으로 받은 경우 마지막 수술 전 보조요법 투여 후 8주 초과, 또는 환자가 수술 전 보조요법을 4주기 받은 경우 수술 전 보조요법의 첫 용법 후 20주 초과 후 수술)을 경험하였다. 위약을 투여 받은 환자 중 수술을 받은 317명의 환자 중에서, 2.5%(8명)는 이상사례로 인해 수술 지연을 경험하였다.
이 약을 투여 받은 환자 중 수술을 받은 325명의 환자 중에서, 7%(22명)는 이상사례로 인해 수술 후 보조요법을 받지 않았다. 위약을 투여 받은 환자 중 수술을 받은 317명의 환자 중에서, 3.2%(10명)는 이상사례로 인해 수술 후 보조요법을 받지 않았다.
KEYNOTE ‑671의 수술 후 보조요법 단계
이 약 투여군의 총 290명의 환자 및 위약군의 총 267명의 환자가 수술 후 보조요법을 투여 받았다.
수술 후 보조요법으로서 이 약을 단독 투여 받은 환자 중에서, 14%는 중대한 이상사례를 경험하였다; 가장 빈번한 중대한 이상사례는 폐렴(3.4%)이었다. 치명적인 이상사례는 폐출혈로써 한 건 발생하였다. 이상사례로 인한 수술 후 보조요법으로서 이 약의 영구적인 투여중단은 환자의 12%에서 발생하였다; 수술 후 보조요법으로서 이 약의 영구적인 투여중단을 야기한 가장 빈번한( ≧1%) 이상사례는 설사(1.7%), 간질성 폐 질환(1.4%), AST 증가(1%), 그리고 근골격 통증(1%)이었다.
단독 요법
표 8은 KEYNOTE ‑010에 참여해 이 약을 투여 받은 이전 치료경험이 있는 비소세포폐암 환자 중 10% 이상에서 보고된 이상사례를 정리한 것이다. 가장 일반적인 이상사례(20% 이상의 환자에서 보고됨)는 식욕감퇴, 피로, 호흡곤란, 오심(구역)이었다. KEYNOTE ‑024에서 이 약을 투여 받은 이전 치료경험이 없는 비소세포폐암 환자들에서 보고된 이상사례는 일반적으로 KEYNOTE ‑010에서 보고된 것들과 유사하였다.
표 8. 이 약을 투여 받은 비소세포폐암 환자 중 10% 이상에서 보고되고 도세탁셀 투여군 이상으로 발생한 이상사례 (KEYNOTE ‑010)
|
|
이 약 2 또는 10 mg/kg 매 3주에 1회 n=682 |
도세탁셀 75 mg/m2 매 3주에 1회 n=309 | ||
|
이상사례 |
모든 등급(%)† |
3-4등급(%) |
모든 등급(%) |
3-4등급(%) |
|
대사 및 영양 장애 | ||||
|
식욕감퇴 |
25 |
1.5 |
23 |
2.6 |
|
위장관 장애 | ||||
|
오심(구역) |
20 |
1.3 |
18 |
0.6 |
|
변비 |
15 |
0.6 |
12 |
0.6 |
|
구토 |
13 |
0.9 |
10 |
0.6 |
|
호흡기, 흉부 및 종격동 장애 | ||||
|
호흡곤란 |
23 |
3.7 |
20 |
2.6 |
|
기침 |
19 |
0.6 |
14 |
0 |
|
근골격계 및 결합조직 장애 | ||||
|
관절통 |
11 |
1.0 |
9 |
0.3 |
|
등허리 통증 |
11 |
1.5 |
8 |
0.3 |
|
피부 및 피하조직 장애 | ||||
|
발진‡ |
17 |
0.4 |
8 |
0 |
|
소양증 |
11 |
0 |
3 |
0.3 |
|
†NCI CTCAE v4.0에 따라 등급을 매겼다. ‡발진, 홍반성 발진, 황반성 발진, 반상-구진 발진, 구진성 발진, 소양성 발진을 포함한다. | ||||
표 9. 이 약을 투여한 비소세포폐암 환자의 20% 이상에서 발생한 기저치보다 악화된 임상검사치 이상 중 도세탁셀 군 이상으로 많이 발생한 이상 (KEYNOTE ‑010)
|
|
이 약 2 또는 10 mg/kg 매 3주에 1회 |
도세탁셀 75 mg/m2 매 3주에 1회 | ||
|
임상검사† |
모든 등급 (%)‡ |
3-4등급 (%) |
모든 등급 (%)‡ |
3-4등급 (%) |
|
화학적 검사 | ||||
|
저나트륨혈증 |
32 |
8 |
27 |
2.9 |
|
ALP 증가 |
28 |
3.0 |
16 |
0.7 |
|
AST 증가 |
26 |
1.6 |
12 |
0.7 |
|
ALT 증가 |
22 |
2.7 |
9 |
0.4 |
|
†시험 기저치가 확인되고 최소 1회 이상 임상검사치 측정이 가능했던 환자에 대해 각 시험별 발생률을 계산하였다: 이 약(631-638명) 및 도세탁셀(274-277명). ‡NCI CTCAE v4.0에 따라 등급을 매겼다. | ||||
절제술을 받은 비소세포폐암의 수술 후 보조요법(adjuvant)
단독 요법으로서의 이 약의 안전성은 완전히 절제된 IB기(T2a ≧4cm), II기 또는 IIIA 비소세포폐암 환자를 대상으로 한 다기관, 무작위 배정(1:1), 삼중 맹검, 위약 대조 시험인 KEYNOTE ‑091에서 평가되었다; 최대 4주기까지의 수술 후 보조요법(adjuvant)으로서 화학요법제 치료는 선택 사항이었다(14. 임상시험 정보 항 참고). 총 1,161명의 환자가 3주마다 이 약 200mg(n=580) 또는 위약(n=581)을 투여 받았다. 활성 자가면역 질환이 있거나, 만성 면역억제제를 복용 중이거나, 간질성 폐 질환이나 폐염증 병력이 있는 환자는 제외되었다.
이 약에 노출된 기간의 중앙값은 11.7개월(범위: 1일~18.9개월)이었다. 이 약 투여군의 68%가 6개월 이상 이 약에 노출되었다.
KEYNOTE ‑091에서 관찰된 이상사례는 갑상선 저하증(22%), 갑상선 항진증(11%), 폐염증(7%)을 제외하고 이 약을 단독 요법으로 투여받은 다른 비소세포폐암 환자에서 발생한 것과 일반적으로 유사했다. 심근염에 대한 2건의 치명적인 약물이상반응이 발생했다.
라. 두경부암
이 약을 단독 요법으로 치료받은 두경부암 환자에서 발생한 이상사례는 흑색종이나 비소세포폐암 환자에서의 이상사례와 전반적으로 비슷하였다.
이 약과 화학요법제(백금 및 5 ‑FU)를 병용 투여로 치료받은 두경부암 환자에서 세툭시맙과 화학요법제(백금 및 5 ‑FU) 병용 투여와의 발생률 차이가 2% 이상인 중증 이상(3 ‑4등급) 이상사례는 다음과 같다: 피로 (7% vs. 4.9%), 점막 염증 (10% vs. 5%), 구내염 (8% vs. 3.5%).
표 10 및 표 11은 KEYNOTE ‑048에 참여해 이 약으로 치료 받은 환자에서의 이상사례와 임상검사치 이상을 요약한 것이다.
표 10. 이 약을 투여받은 환자 중 10% 이상의 환자에서 발생한 이상사례 (KEYNOTE ‑048)
|
이상사례 |
이 약 200mg 매 3주에 1회 n=300 |
이 약 200mg 매 3주에 1회 + 백금 + 플루오로우라실 n=276 |
세툭시맙 + 백금 + 플루오로우라실 n=287 | |||
|
모든 등급* (%) |
3-4 등급 (%) |
모든 등급* (%) |
3-4 등급 (%) |
모든 등급* (%) |
3-4 등급 (%) | |
|
전신 장애 | ||||||
|
피로† |
33 |
4 |
49 |
11 |
48 |
8 |
|
발열 |
13 |
0.7 |
16 |
0.7 |
12 |
0 |
|
점막 염증 |
4.3 |
1.3 |
31 |
10 |
28 |
5 |
|
위장관 장애 | ||||||
|
변비 |
20 |
0.3 |
37 |
0 |
33 |
1.4 |
|
오심 |
17 |
0 |
51 |
6 |
51 |
6 |
|
설사‡ |
16 |
0.7 |
29 |
3.3 |
35 |
3.1 |
|
구토 |
11 |
0.3 |
32 |
3.6 |
28 |
2.8 |
|
연하 곤란 |
8 |
2.3 |
12 |
2.9 |
10 |
2.1 |
|
구내염 |
3 |
0 |
26 |
8 |
28 |
3.5 |
|
피부 장애 | ||||||
|
발진§ |
20 |
2.3 |
17 |
0.7 |
70 |
8 |
|
소양증 |
11 |
0 |
8 |
0 |
10 |
0.3 |
|
호흡기, 흉부 및 종격동 장애 | ||||||
|
기침¶ |
18 |
0.3 |
22 |
0 |
15 |
0 |
|
호흡 곤란# |
14 |
2.0 |
10 |
1.8 |
8 |
1.0 |
|
내분비 장애 | ||||||
|
갑상선 저하증 |
18 |
0 |
15 |
0 |
6 |
0 |
|
대사 및 영양 장애 | ||||||
|
식욕 감소 |
15 |
1.0 |
29 |
4.7 |
30 |
3.5 |
|
체중 감소 |
15 |
2 |
16 |
2.9 |
21 |
1.4 |
|
감염 | ||||||
|
폐렴Þ |
12 |
7 |
19 |
11 |
13 |
6 |
|
신경계 장애 | ||||||
|
두통 |
12 |
0.3 |
11 |
0.7 |
8 |
0.3 |
|
어지러움 |
5 |
0.3 |
10 |
0.4 |
13 |
0.3 |
|
말초 감각 신경 병증β |
1 |
0 |
14 |
1.1 |
7 |
1 |
|
근골격계 장애 | ||||||
|
근육통à |
12 |
1.0 |
13 |
0.4 |
11 |
0.3 |
|
경부 통증 |
6 |
0.7 |
10 |
1.1 |
7 |
0.7 |
|
정신의학적 장애 | ||||||
|
불면 |
7 |
0.7 |
10 |
0 |
8 |
0 |
|
*NCI CTCAE v4.0에 따라 등급을 매겼다. †피로, 무력증을 포함한다. ‡설사, 결장염, 출혈성 설사, 현미경적 결장염을 포함한다. §피부염, 여드름양 피부염, 알레르기성 피부염, 수포성 피부염, 접촉 피부염, 탈락 피부염, 약물 발진, 홍반, 다형성 홍반, 발진, 홍반성 발진, 전신 발진, 반상 발진, 반상-구진 발진, 소양성 발진, 지루성 피부염을 포함한다. ¶기침, 습성 기침을 포함한다. #호흡 곤란, 노작성 호흡 곤란을 포함한다. Þ폐렴, 비정형 폐렴, 세균성 폐렴, 포도상 구균 폐렴, 흡인성 폐렴, 하기도 감염, 폐 감염, 슈도모나스 폐 감염을 포함한다. β말초 감각 신경 병증, 말초 신경 병증, 감각 저하, 이상 감각을 포함한다. à등허리 통증, 근골격성 흉부 통증, 근골격 통증, 근육통을 포함한다. | ||||||
|
임상검사* |
이 약 200mg 매 3주에 1회 |
이 약 200mg 매 3주에 1회 + 백금 + 플루오로우라실 |
세툭시맙 + 백금 + 플루오로우라실 | |||
|
모든 등급† (%) |
3-4 등급 (%) |
모든 등급† (%) |
3-4 등급 (%) |
모든 등급† (%) |
3-4 등급 (%) | |
|
혈액학적 검사 | ||||||
|
림프구 감소증 |
54 |
25 |
69 |
35 |
74 |
45 |
|
빈혈 |
52 |
7 |
89 |
28 |
78 |
19 |
|
혈소판 감소증 |
12 |
3.8 |
73 |
18 |
76 |
18 |
|
중성구 감소증 |
7 |
1.4 |
67 |
35 |
71 |
42 |
|
화학적 검사 | ||||||
|
고혈당증 |
47 |
3.8 |
55 |
6 |
66 |
4.7 |
|
저나트륨 혈증 |
46 |
17 |
56 |
20 |
59 |
20 |
|
저알부민 혈증 |
44 |
3.2 |
47 |
4.0 |
49 |
1.1 |
|
AST 증가 |
28 |
3.1 |
24 |
2.0 |
37 |
3.6 |
|
ALT 증가 |
25 |
2.1 |
22 |
1.6 |
38 |
1.8 |
|
알칼리 인산 분해 효소 증가 |
25 |
2.1 |
27 |
1.2 |
33 |
1.1 |
|
고칼슘 혈증 |
22 |
4.6 |
16 |
4.3 |
13 |
2.6 |
|
저칼슘 혈증 |
22 |
1.1 |
32 |
4 |
58 |
7 |
|
고칼륨 혈증 |
21 |
2.8 |
27 |
4.3 |
29 |
4.3 |
|
저인산 혈증 |
20 |
5 |
35 |
12 |
48 |
19 |
|
저칼륨 혈증 |
19 |
5 |
34 |
12 |
47 |
15 |
|
크레아티닌 증가 |
18 |
1.1 |
36 |
2.3 |
27 |
2.2 |
|
저마그네슘 혈증 |
16 |
0.4 |
42 |
1.7 |
76 |
6 |
|
*시험 기저치가 확인되고 최소 1회 이상 임상검사치 측정이 가능했던 환자에 대해 각 시험별 발생률을 계산하였다: 이 약+화학요법제(235-266명), 이 약(241-288명) 및 세툭시맙+화학요법제(249-282명). †NCI CTCAE v4.0에 따라 등급을 매겼다.
| ||||||
단독 요법
전형적 호지킨림프종, 요로상피암, MSI ‑H암, 직결장암, 신세포암의 수술 후 보조요법(adjuvant) 또는 간세포암 환자에서 발생한 이상사례는 흑색종이나 비소세포폐암 환자에서의 이상사례와 전반적으로 비슷하였다.
BCG ‑불응 고위험 비근침습성 방광암
이 약의 안전성은 고위험 비근침습성 방광암 환자 148명을 등록한 다기관, 공개라벨, 단일군 시험인 KEYNOTE ‑057에서 조사되었으며, 이 중 96명은 유두종 유무에 상관없이 상피내암을 동반한 BCG ‑불응이었다. 환자는 허용 불가능한 독성, 지속적 또는 재발성 고위험 비근침습성 방광암이거나 진행성 질환, 또는 질환의 진행 없이 최대 24개월까지 이 약 200mg을 매 3주 투약하였다. 이 약의 노출 기간 중앙값은 4.3개월(범위: 1일 ~ 25.6개월)이었다. 환자의 11%가 이상사례로 이 약 투여를 중단하였다. 이 약의 영구 중단으로 이어진 가장 빈번한 이상사례(>1%)는 폐염증(1.4%)이었다. 이 약의 일시 중단으로 이어진 이상사례는 환자의 22%에서 발생하였다; 2% 이상에서 보고된 가장 빈번한 이상사례는 설사(4%), 요로 감염(2%)이었다. 중대한 이상사례는 이 약을 투여 받은 환자의 28%에서 발생하였다. 이 약을 치료받은 환자에서 2% 이상으로 가장 빈번하게 보고된 중대한 이상사례는 페렴(3%), 심허혈(2%), 결장염(2%), 폐 색전증(2%), 패혈증(2%), 그리고 요로 감염(2%)이었다. 표 12 및 표 13은 KEYNOTE ‑057에 참여해 이 약으로 치료받은 환자에서 발생한 이상사례 및 임상검사치 이상을 요약한 것이다.
표 12. 이 약을 투여받은 환자 중 10% 이상에서 발생한 이상사례 (KEYNOTE ‑057)
| 이상사례 |
이 약 200mg 매 3주에 1회 n=148 | |
|
모든 등급* (%) |
3-4등급 (%) | |
|
전신 장애 | ||
|
피로† |
29 |
0.7 |
|
말초 부종‡ |
11 |
0 |
|
위장관 장애 | ||
|
설사§ |
24 |
2.0 |
|
오심 |
13 |
0 |
|
변비 |
12 |
0 |
|
피부 및 피하조직 장애 | ||
|
발진¶ |
24 |
0.7 |
|
소양증 |
19 |
0.7 |
|
근골격계 및 결합조직 장애 | ||
|
근골격 통증# |
19 |
0 |
|
관절통 |
14 |
1.4 |
|
신장 및 요로계 장애 | ||
|
혈뇨 |
19 |
1.4 |
|
호흡기, 흉부 및 종격동 장애 | ||
|
기침Þ |
19 |
0 |
|
감염 | ||
|
요로 감염 |
12 |
2.0 |
|
비인두염 |
10 |
0 |
|
내분비 장애 | ||
|
갑상선 저하증 |
11 |
0 |
|
*NCI CTCAE v4.03에 따라 등급을 매겼다. †무력증, 피로, 병감(권태)을 포함한다. ‡말초 부종 및 말초 종창을 포함한다. §설사, 위장염, 결장염을 포함한다. ¶반상-구진 발진, 발진, 홍반성 발진, 소양성 발진, 농포성 발진, 홍반, 습진, 건조 습진, 태선형 각화증, 두드러기, 피부염을 포함한다. #등허리 통증, 근육통, 근골격 통증, 사지 통증, 근골격성 흉부 통증, 경부 통증을 포함한다. Þ기침, 습성 기침을 포함한다.
| ||
|
임상 검사* |
이 약 200mg 매 3주에 1회 | |
|
모든 등급† (%) |
3-4 등급 (%) | |
|
화학적 검사 |
|
|
|
고혈당증 |
59 |
8 |
|
ALT 증가 |
25 |
3.4 |
|
저나트륨 혈증 |
24 |
7 |
|
저인산 혈증 |
24 |
6 |
|
저알부민 혈증 |
24 |
2.1 |
|
고칼륨 혈증 |
23 |
1.4 |
|
저칼슘 혈증 |
22 |
0.7 |
|
AST 증가 |
20 |
3.4 |
|
크레아티닌 증가 |
20 |
0.7 |
|
혈액학적 검사 |
|
|
|
빈혈 |
35 |
1.4 |
|
림프구 감소증 |
29 |
1.6 |
|
*시험 기저치가 확인되고 최소 1회 이상 임상검사치 측정이 가능했던 환자에 대해 각 시험별 발생률을 계산하였다: 이 약(124-147명) †NCI CTCAE v4.03에 따라 등급을 매겼다. | ||
악성 흉막 중피종
이 약과 페메트렉시드 및 백금 화학요법과의 병용 요법의 안전성은 이전에 치료받은 적이 없는 수술이 불가능한 진행성 또는 전이성 악성 흉막 중피종 환자들을 대상으로 한 다기관, 공개라벨, 무작위배정(1:1), 활성 대조군 임상시험인 KEYNOTE ‑483에서 평가되었다 [14. 임상시험 정보항 참고]. 총 473명의 환자가 매 3주마다 이 약 200 mg 과 페메트렉시드 및 백금 화학 요법을 최대 6주기동안 투여받은 후, 매 3주마다 최대 6주기동안 이 약(n=241) 또는 페메트렉시드 및 백금화학요법을 투여받았다(n=232). 3년이내 치료 동안 전신 치료가 필요했던 자가면역질환 또는 면역 억제를 필요로 하는 의학적 상태를 가진 환자는 제외되었다.
매 3주마다 이 약 200 mg에 대한 노출 기간 중앙값은 6.9개월(범위: 1일 ‑25.2개월)이었다. 이 약 치료군인 환자의 61%가 이 약에 6개월 이상 노출되었다.
악성 흉막 중피종 환자에서 발생한 이상사례는 이 약을 페메트렉시드 및 백금 화학요법과 병용 투여받은 환자에서의 이상사례와 전반적으로 비슷하였다.
요로상피암
이 약과 엔포투맙베도틴 병용 요법의 안전성은 국소 진행성 또는 전이성 요로상피암 환자들을 대상으로 한 KEYNOTE ‑A39에서 평가되었다 [14. 임상시험 정보항 참고]. 총 440명의 환자가 21일 주기의 1일차에 이 약 200 mg과 1일차와 8일차에 엔포투맙베도틴 1.25 mg/kg를 투여 받았고, 433명의 환자는 21일 주기의 1일차와 8일차에 젬시타빈과 21일 주기의 1일차에 연구자의 선택으로 시스플라틴 또는 카보플라틴을 투여 받았다. 이 약과 엔포투맙 베도틴을 투여받은 환자들 중 이 약에 대한 노출기간의 중앙값은 8.5개월(범위: 9일 ‑28.5개월)이었다.
치명적인 이상사례는 이 약과 엔포투맙베도틴 병용 요법으로 치료받은 환자의 3.9%에서 발생했으며, 이 중에는 급성 호흡 부전(0.7%), 폐렴(0.5%), 폐염증/간질성 폐 질환(0.2%) 등이 포함되었다.
중대한 이상사례는 이 약과 엔포투맙베도틴 병용 요법으로 치료받은 환자의 50%에서 발생했다. 이 약과 엔포투맙베도틴 병용 요법으로 치료받은 환자의 2% 이상에서 발생한 중대한 이상사례는 발진(6%), 급성 신 손상(5%), 폐염증/간질성 폐 질환(4.5%), 요로감염(3.6%), 설사(3.2%), 폐렴(2.3%), 발열(2%), 그리고 고혈당증(2%)이었다.
이 약의 영구적인 투여중단은 환자의 27%에서 발생했으며, 이 약의 영구적인 투여중단을 야기한 가장 빈번한( ≧2%) 이상사례는 폐염증/간질성 폐 질환(4.8%)과 발진(3.4%)이었다.
이 약의 일시적인 투여중단은 환자의 61%에서 발생했으며, 이 약의 일시적인 투여중단을 야기한 가장 빈번한( ≧2%) 이상사례는 발진(17%), 말초 신경 병증 (7%), COVID ‑19(5%), 설사(4.3%), 폐염증/간질성 폐 질환(3.6%), 중성구감소증(3.4%), 피로(3%), 알라닌 아미노 전이효소 증가(2.7%), 고혈당증(2.5%), 폐렴(2%), 그리고 소양증(2%)이었다.
표 14 및 표 15는 KEYNOTE ‑A39에서 이 약과 엔포투맙베도틴 병용 요법으로 치료받은 환자에서 발생한 이상사례와 임상검사치 이상을 각각 요약한 것이다.
표 14. 이 약과 엔포투맙베도틴 병용 요법으로 치료받은 환자 중 20% 이상의 환자에서 발생한 이상사례 (모든 등급) (KEYNOTE ‑A39)
|
이상사례 |
이 약과 엔포투맙베도틴 병용 요법 n=440 |
항암화학요법 n=433 | ||
|
모든 등급*(%) |
3-4등급(%) |
모든 등급*(%) |
3-4등급(%) | |
|
피부 및 피하조직 장애 | ||||
|
발진† |
68 |
15 |
15 |
0 |
|
소양증 |
41 |
1.1 |
7 |
0 |
|
탈모 |
35 |
0.5 |
8 |
0.2 |
|
전신 장애 및 투여부위 상태 | ||||
|
피로† |
51 |
6 |
57 |
7 |
|
신경계 장애 | ||||
|
말초 신경 병증† |
67 |
8 |
14 |
0 |
|
미각 이상 |
21 |
0 |
9 |
0 |
|
대사 및 영양장애 | ||||
|
식욕 감소 |
33 |
1.8 |
26 |
1.8 |
|
위장관 장애 | ||||
|
설사 |
38 |
4.5 |
16 |
1.4 |
|
오심 |
26 |
1.6 |
41 |
2.8 |
|
변비 |
26 |
0 |
34 |
0.7 |
|
임상검사 | ||||
|
체중 감소 |
33 |
3.6 |
9 |
0.2 |
|
눈 장애 | ||||
|
눈 건조† |
24 |
0 |
2.1 |
0 |
|
감염 및 감염증 | ||||
|
요로 감염 |
21 |
5 |
19 |
8 |
|
* NCI CTCAE v4.03에 따라 등급을 매겼다. † 다수의 이상사례명을 포함한다. | ||||
표 15. 20% 이상의 환자에서 발생한 기저치보다 악화된 임상검사치 이상 (KEYNOTE ‑A39)
|
임상검사* |
매 3주마다 이 약 200 mg + 엔포투맙베도틴 |
항암화학요법 | ||
|
모든 등급 (%)† |
3-4 등급 (%) |
모든 등급 (%)† |
3-4 등급 (%) | |
|
화학적 검사 | ||||
|
아스파르트산 아미노 전이 효소 증가 |
75 |
4.6 |
39 |
3.3 |
|
크레아티닌 증가 |
71 |
3.2 |
68 |
2.6 |
|
고혈당증 |
66 |
14 |
54 |
4.7 |
|
알라닌 아미노 전이 효소 증가 |
59 |
5 |
49 |
3.3 |
|
저나트륨 혈증 |
46 |
13 |
47 |
13 |
|
저인산 혈증 |
44 |
9 |
36 |
9 |
|
저알부민 혈증 |
39 |
1.8 |
35 |
0.5 |
|
저칼륨 혈증 |
26 |
5 |
16 |
3.1 |
|
고칼륨 혈증 |
24 |
1.4 |
36 |
4.0 |
|
고칼슘 혈증 |
21 |
1.2 |
14 |
0.2 |
|
혈액학적 검사 | ||||
|
림프구 감소증 |
58 |
15 |
59 |
17 |
|
빈혈 |
53 |
7 |
89 |
33 |
|
중성구 감소증 |
30 |
9 |
80 |
50 |
|
* 시험 기저치가 확인되고 최소 1회 이상 임상검사치 측정이 가능했던 환자에 대해 각 시험별 발생률을 계산하였다: 이 약 (범위: 407-439명) † NCI CTCAE v4.03에 따라 등급을 매겼다. | ||||
HER2 양성 위암
이 약과 트라스투주맙 및 항암화학요법(플루오로피리미딘 및 백금)의 병용 요법으로 치료 받은 위암 환자 중 최소 20% 이상에서 보고되고, 위약과 트라스투주맙 및 항암화학요법(플루오로피리미딘 및 백금)의 병용 요법과의 발생률 차이가 2% 이상인 3 ‑4등급 이상사례는 피로(4.6% vs. 2.6%)였다(KEYNOTE ‑811).
표 16. 이 약을 투여받은 환자 중 20% 이상의 환자에서 발생한 이상사례 (KEYNOTE ‑811)
|
이상사례 |
이 약 200 mg 매 3주에 1회 + 트라스투주맙 + 플루오로피리미딘 및 백금 화학요법제 n=350 |
위약 +
트라스투주맙 + 플루오로피리미딘 및 백금 화학요법제 n=346 | ||
|
모든 등급*(%) |
3-4등급(%) |
모든 등급*(%) |
3-4등급(%) | |
|
위장관 장애 | ||||
|
설사 |
52 |
10 |
46 |
8 |
|
오심 |
48 |
4.0 |
48 |
5 |
|
구토 |
32 |
4.9 |
29 |
3.2 |
|
대사 및 영양장애 | ||||
|
식욕 감소 |
31 |
3.7 |
32 |
4.0 |
|
신경계 장애 | ||||
|
말초 감각 신경 병증 |
24 |
3.7 |
21 |
2.0 |
|
전신 장애 | ||||
|
피로 |
23 |
4.6 |
22 |
2.6 |
|
피부 및 피하조직 장애 | ||||
|
손바닥-발바닥 홍반성 감각 이상 증후군 |
23 |
1.4 |
22 |
1.4 |
|
임상검사 | ||||
|
체중 감소 |
21 |
2.0 |
17 |
1.2 |
|
* NCI CTCAE v4.03에 따라 등급을 매겼다. | ||||
|
임상검사* |
이 약 200 mg 매 3주에 1회 + 트라스투주맙 + 플루오로피리미딘 및 백금 화학요법제 n=350 |
위약 +
트라스투주맙 + 플루오로피리미딘 및 백금 화학요법제 n=346 | ||
|
모든 등급 (%)† |
3-4 등급 (%) |
모든 등급 (%)† |
3-4 등급 (%) | |
|
혈액학적 검사 | ||||
|
빈혈 |
71 |
17 |
66 |
14 |
|
중성구 감소증 |
64 |
20 |
59 |
18 |
|
혈소판 수 감소 |
65 |
13 |
63 |
11 |
|
백혈구 수 감소 |
59 |
7 |
54 |
7 |
|
림프구 감소증 |
58 |
19 |
51 |
16 |
|
화학적 검사 | ||||
|
저알부민 혈증 |
56 |
2.9 |
52 |
3.9 |
|
고혈당증 |
51 |
7 |
56 |
6 |
|
AST 증가 |
52 |
4.9 |
51 |
3.0 |
|
저칼슘 혈증 |
55 |
3.5 |
45 |
2.4 |
|
ALT 증가 |
40 |
3.5 |
36 |
1.8 |
|
저칼륨 혈증 |
40 |
13 |
35 |
12 |
|
알칼리 인산 분해 효소 증가 |
39 |
2.9 |
39 |
4.2 |
|
저인산 혈증 |
33 |
10 |
34 |
10 |
|
저마그네슘 혈증 |
29 |
1.2 |
29 |
0.6 |
|
저나트륨 혈증 |
32 |
8 |
32 |
10 |
|
혈액 빌리루빈 증가 |
31 |
4.1 |
25 |
2.7 |
|
크레아티닌 증가 |
26 |
3.2 |
17 |
2.1 |
|
* 시험 기저치가 확인되고 최소 1회 이상 임상검사치 측정이 가능했던 환자에 대해 각 시험별 발생률을 계산하였다: 이 약+트라스투주맙+플루오로피리미딘 및 백금 화학요법제(범위: 342-347명) 및 위약+트라스투주맙+플루오로피리미딘 및 백금 화학요법제(범위: 333-340명). † NCI CTCAE v4.03에 따라 등급을 매겼다. | ||||
이 약과 화학요법제(플루오로피리미딘 및 백금)를 병용 투여 받은 위암 환자 중 최소 20%에서 보고되고, 위약과 화학요법제(플루오로피리미딘 및 백금)의 병용 투여와 비교하였을 때 발생률 차이가 2% 이상인 3 ‑4등급 이상사례는 다음과 같다: 빈혈(12% vs. 10%), 혈소판 수 감소(7% vs. 5%)(KEYNOTE ‑859).
식도암
이 약과 화학요법제(시스플라틴 및 5 ‑FU)를 병용 투여로 치료받은 식도암 환자에서, 위약과 화학요법제(시스플라틴 및 5 ‑FU) 병용 투여와 비교하였을 때 20% 이상의 환자에서 발생하고 2% 이상의 높은 발생율을 보인 3 ‑5등급 이상사례는 다음과 같다: 구토 (7% vs. 5%), 구내염 (6% vs. 3.8%), 중성구 수 감소 (24.1% vs 17.3%), 백혈구 수 감소 (9.2% vs. 4.9%).
표 18 및 표 19는 KEYNOTE ‑590에 참여해 이 약으로 치료 받은 환자에서의 이상사례와 임상검사치 이상을 요약한 것이다.
표 18. 이 약을 투여받은 환자 중 20% 이상의 환자에서 발생한 이상사례 (KEYNOTE ‑590)
| 이상사례 |
이 약 200 mg 매 3주에 1회 + 시스플라틴 + 플루오로우라실 n=370 |
위약 + 시스플라틴 + 플루오로우라실 n=370 | ||
|
모든 등급* (%) |
3-4 등급† (%) |
모든 등급* (%) |
3-4 등급† (%) | |
|
위장관 장애 | ||||
|
오심 |
67 |
7 |
63 |
7 |
|
변비 |
40 |
0 |
40 |
0 |
|
설사 |
36 |
4.1 |
33 |
3 |
|
구토 |
34 |
7 |
32 |
5 |
|
구내염 |
27 |
6 |
26 |
3.8 |
|
전신 장애 | ||||
|
피로‡ |
57 |
12 |
46 |
9 |
|
대사 및 영양 장애 | ||||
|
식욕 감소 |
44 |
4.1 |
38 |
5 |
|
임상 검사 | ||||
|
체중 감소 |
24 |
3.0 |
24 |
5 |
|
*NCI CTCAE v4.03에 따라 등급을 매겼다. †각 투여군에서 설사가 치명적인 사례로 1건씩 보고되었다. ‡무력증, 피로를 포함한다. | ||||
|
임상검사* |
이 약 200 mg 매 3주에 1회 + 시스플라틴 + 플루오로우라실 |
화학요법제 (시스플라틴 + 플루오로우라실) | ||
|
모든 등급† (%) |
3-4 등급 (%) |
모든 등급† (%) |
3-4 등급 (%) | |
|
혈액학적 검사 | ||||
|
빈혈 |
83 |
21 |
86 |
24 |
|
중성구 감소증 |
74 |
43 |
71 |
41 |
|
백혈구 감소증 |
72 |
21 |
73 |
17 |
|
림프구 감소증 |
55 |
22 |
53 |
18 |
|
혈소판 감소증 |
43 |
5 |
46 |
8 |
|
화학적 검사 | ||||
|
고혈당증 |
56 |
7 |
55 |
6 |
|
저나트륨 혈증 |
53 |
19 |
54 |
19 |
|
저알부민 혈증 |
52 |
2.8 |
52 |
2.3 |
|
크레아티닌 증가 |
45 |
2.5 |
42 |
2.5 |
|
저칼슘 혈증 |
44 |
3.9 |
38 |
2 |
|
저인산 혈증 |
37 |
9 |
31 |
10 |
|
저칼륨 혈증 |
30 |
12 |
34 |
15 |
|
알칼리 인산 분해 효소 증가 |
29 |
1.9 |
29 |
1.7 |
|
고칼륨 혈증 |
28 |
3.6 |
27 |
2.6 |
|
AST 증가 |
25 |
4.4 |
22 |
2.8 |
|
ALT 증가 |
23 |
3.6 |
18 |
1.7 |
|
*시험 기저치가 확인되고 최소 1회 이상 임상검사치 측정이 가능했던 환자에 대해 각 시험별 발생률을 계산하였다: 이 약+시스플라틴+플루오로우라실(345-365명) 및 위약+시스플라틴+플루오로우라실 (330-358명). †NCI CTCAE v4.03에 따라 등급을 매겼다. | ||||
엑시티닙과의 병용 요법(KEYNOTE ‑426)
KEYNOTE ‑426에서 이 약과 엑시티닙의 병용 요법으로 치료받은 이전 치료 경험이 없는 신세포암 환자 중 20% 이상에서 보고된 가장 일반적인 이상사례는 설사, 피로/무력증, 고혈압, 갑상선 저하증, 식욕 감퇴, 간독성, 손바닥 ‑발바닥 홍반 감각이상증, 오심, 구내염/점막 염증, 발성 장애, 발진, 기침, 변비였다.
표 20 및 표 21은 KEYNOTE ‑426에 참여해 이 약과 엑시티닙 병용 요법으로 치료받은 환자 중 20% 이상에서 발생한 이상 사례 및 임상검사치 이상을 요약한 것이다.
표 20. 이 약과 엑시티닙을 함께 투여받은 환자 중 20% 이상에서 발생한 이상사례 (KEYNOTE ‑426)
|
|
이 약 + 엑시티닙 n=429 |
수니티닙 n=425 | ||
|
이상사례 |
모든 등급* (%) |
3-4등급 (%) |
모든 등급 (%) |
3-4등급 (%) |
|
위장관 장애 | ||||
|
설사† |
56 |
11 |
45 |
5 |
|
오심 |
28 |
0.9 |
32 |
0.9 |
|
변비 |
21 |
0 |
15 |
0.2 |
|
전신 장애 | ||||
|
피로/무력증 |
52 |
5 |
51 |
10 |
|
심혈관 장애 | ||||
|
고혈압‡ |
48 |
24 |
48 |
20 |
|
간 장애 | ||||
|
간독성§ |
39 |
20 |
25 |
4.9 |
|
내분비 장애 | ||||
|
갑상선 저하증 |
35 |
0.2 |
32 |
0.2 |
|
대사 및 영양 장애 | ||||
|
식욕 감퇴 |
30 |
2.8 |
29 |
0.7 |
|
피부 및 피하조직 장애 | ||||
|
손바닥-발바닥 홍반 감각이상증 |
28 |
5 |
40 |
3.8 |
|
구내염/점막 염증 |
27 |
1.6 |
41 |
4 |
|
발진¶ |
25 |
1.4 |
21 |
0.7 |
|
호흡기, 흉부 및 종격동 장애 | ||||
|
발성 장애 |
25 |
0.2 |
3.3 |
0 |
|
기침 |
21 |
0.2 |
14 |
0.5 |
|
*NCI CTCAE v4.03에 따라 등급을 매겼다. †설사, 결장염, 장결장염, 위장염, 장염, 출혈성 장결장염을 포함한다. ‡고혈압, 혈압 상승, 고혈압성 위기, 불안정 고혈압을 포함한다. §ALT증가, AST 증가, 자가면역성 간염, 혈중 빌리루빈 증가, 약물 유발성 간 손상, 간효소 증가, 간기능 이상, 간염, 전격성 간염, 간세포성 손상, 간독성, 고빌리루빈혈증, 면역-매개 간염, 간기능검사치 증가, 간 손상, 아미노전이효소 증가를 포함한다. ¶발진, 나비모양 발진, 피부염, 여드름양 피부염, 아토피피부염, 수포성 피부염, 접촉성 피부염, 박리성 피부염, 생식기 발진, 홍반성 발진, 전신발진, 황반성 발진, 반구진발진, 구진성 발진, 소양성 발진, 지루성 피부염, 피부 탈락, 피부 박리, 회음부 발진을 포함한다. | ||||
|
|
이 약 + 엑시티닙 |
수니티닙 | ||
|
임상검사* |
모든 등급† (%) |
3-4 등급 (%) |
모든 등급 (%) |
3-4 등급 (%) |
|
화학적 검사 | ||||
|
고혈당증 |
62 |
9 |
54 |
3.2 |
|
ALT 증가 |
60 |
20 |
44 |
5 |
|
AST 증가 |
57 |
13 |
56 |
5 |
|
크레아티닌 증가 |
43 |
4.3 |
40 |
2.4 |
|
저나트륨혈증 |
35 |
8 |
29 |
8 |
|
고칼륨혈증 |
34 |
6 |
22 |
1.7 |
|
저알부민혈증 |
32 |
0.5 |
34 |
1.7 |
|
고칼슘혈증 |
27 |
0.7 |
15 |
1.9 |
|
저인산혈증 |
26 |
6 |
49 |
17 |
|
ALP 증가 |
26 |
1.7 |
30 |
2.7 |
|
저칼슘혈증‡ |
22 |
0.2 |
29 |
0.7 |
|
혈중 빌리루빈 증가 |
22 |
2.1 |
21 |
1.9 |
|
활성화된 부분 트롬보플라스틴 시간 (aPTT) 연장 § |
22 |
1.2 |
14 |
0 |
|
혈액학적 검사 | ||||
|
림프구 감소증 |
33 |
11 |
46 |
8 |
|
빈혈 |
29 |
2.1 |
65 |
8 |
|
혈소판 감소증 |
27 |
1.4 |
78 |
14 |
|
*시험 기저치가 확인되고 최소 1회 이상 임상검사치 측정이 가능했던 환자에 대해 각 시험별 발생률을 계산하였다: 이 약+엑시티닙(342-425명) 및 수니티닙(345-422명). †NCI CTCAE v4.03에 따라 등급을 매겼다. ‡알부민으로 보정되었다. §상승된 활성화된 부분 트롬보플라스틴 시간(aPTT) 연장을 보인 두 명의 3등급 환자에서 간독성 이상사례가 함께 보고되었다. | ||||
표 22는 KEYNOTE ‑581에 참여해 이 약과 렌바티닙 병용 요법으로 치료 받은 환자 중 20% 이상에서 발생한 이상사례를 요약한 것이다.
표 22. 이 약과 렌바티닙 병용 요법으로 치료 받은 환자 중 20% 이상에서 보고되고, 수니티닙 투여군 이상으로 많이 발생한 이상 사례
(두 군간 차이는 모든 등급에서 5% 이상 또는 3 ‑4등급에서 2% 이상) (KEYNOTE ‑581)
|
|
이 약 + 렌바티닙 n=352 |
수니티닙 n=340 | ||
|
이상사례 |
모든 등급*(%) |
3-4등급(%) |
모든 등급*(%) |
3-4등급(%) |
|
위장관 장애 | ||||
|
설사 |
61 |
10 |
49 |
5 |
|
오심 |
36 |
2.6 |
33 |
0.6 |
|
구토 |
26 |
3.4 |
20 |
1.5 |
|
변비 |
25 |
0.9 |
19 |
0 |
|
복통 |
21 |
2.0 |
8 |
0.9 |
|
심혈관 장애 | ||||
|
고혈압 |
55 |
28 |
41 |
19 |
|
내분비 장애 | ||||
|
갑상선 저하증 |
47 |
1.4 |
26 |
0 |
|
대사 및 영양 장애 | ||||
|
식욕 감소 |
40 |
4.0 |
31 |
1.5 |
|
호흡기, 흉부 및 종격동 장애 | ||||
|
발성 장애 |
30 |
0 |
4.1 |
0 |
|
임상 검사 | ||||
|
체중 감소 |
30 |
8 |
9 |
0.3 |
|
신장 및 요로계 장애 | ||||
|
단백뇨 |
30 |
8 |
13 |
2.9 |
|
피부 및 피하조직 장애 | ||||
|
발진 |
27 |
3.7 |
14 |
0.6 |
|
근골격계 및 결합조직 장애 | ||||
|
관절통 |
28 |
1.4 |
15 |
0.3 |
|
신경계 장애 | ||||
|
두통 |
23 |
0.6 |
16 |
0.9 |
자궁내막암
카보플라틴 및 파클리탁셀과의 병용 요법(KEYNOTE ‑868)
항암화학요법(파클리탁셀 및 카보플라틴)과 병용 투여한 이 약의 안전성은 진행성 또는 재발성 자궁내막암 환자를 대상으로 했던 무작위 배정(1:1), 다기관, 이중 맹검, 위약 대조 임상시험인 KEYNOTE ‑868에서 평가되었다. 총 759명의 환자가 매 3주마다 이 약 200 mg 및 항암화학요법을 6 주기동안 투여받은 후 매 6주마다 이 약 400 mg을 최대 14주기동안 투여받거나(n=382), 위약 및 항암화학요법을 6주기동안 투여받은 후 위약을 최대 14주기동안 투여받았다(n=377). 이 약에 대한 노출 기간 중앙값은 5.6개월(범위: 1일 ‑24.0개월)이었다.
중대한 이상사례는 이 약을 항암화학요법과 병용하여 투여받은 환자의 35%에서 발생하였으며, 위약을 항암화학요법과 병용하여 투여받은 환자의 19%에서 발생하였다.
치명적인 이상사례는 이 약을 항암화학요법과 병용하여 투여받은 환자의 1.6%에서 발생하였으며, COVID ‑19(0.5%)와 심정지(0.3%)를 포함하였다.
이 약은 14%의 환자에서 이상사례로 인해 투여가 영구적으로 중단되었다. 이 약을 항암화학요법과 병용하여 투여받은 환자의 29%, 위약을 항암화학요법과 병용하여 투여받은 환자의 23%에서 항암화학요법의 용량 감소가 요구되었다. 항암화학요법의 영구적인 투여중단 또는 일시적인 투여중단은 두 군에서 임상적으로 의미 있는 차이가 없었다.
이 약과 항암화학요법을 투여받은 환자에서 발생한 이상사례는 발진(모든 등급 33%; 3 ‑4등급 2.9%)을 제외하고는 이 약 단독요법 또는 항암화학요법 단독요법을 투여받은 환자에서 관찰된 이상사례와 전반적으로 비슷하였다.
렌바티닙과의 병용 요법(KEYNOTE ‑775 및 KEYNOTE ‑146)
표 23 및 표 24는 KEYNOTE ‑775에 참여해 이 약과 렌바티닙 병용 요법으로 치료받은 MSI ‑H 또는 dMMR이 없는 자궁내막암 환자 중 20%이상에서 발생한 이상사례와 임상검사치 이상을 요약한 것이다. KEYNOTE ‑146에서 이 약과 렌바티닙의 병용요법으로 치료받은 자궁내막암 환자들에서 보고된 이상사례는 일반적으로 KEYNOTE ‑775에서 보고된 것들과 유사하였다.
치명적인 이상사례는 이 약과 렌바티닙 병용요법군에서 4.7% 발생하였고 이는 폐렴 2건 및 급성 신 손상, 급성 심근 경색, 결장염, 식욕 감소, 장 천공, 하부 위장관 출혈, 악성 위장관 폐쇄, 다발성 장기 기능 부전 증후군, 골수 형성 이상 증후군, 폐 색전증, 우심실 기능 장애 1건이었다.
이 약과 렌바티닙을 병용 투여한 환자의 50%에서 중대한 이상사례가 발생하였다. 중대한 이상사례(3% 이상)는 고혈압(4.4%)과 요로감염(3.2%)이었다.
이상사례로 인한 이 약의 투여 중단은 15%의 환자에게서 발생하였다. 이 약의 투여 중단으로 이어진 가장 흔한 이상사례(1% 이상)는 ALT 증가(1.2%)였다.
이상사례로 인한 이 약의 투약 일시 중단은 48%의 환자에게서 발생하였다. 이 약의 투약 일시 중단을 초래한 가장 흔한 이상사례(3% 이상)는 설사(8%), ALT 증가(4.4%), AST 증가(3.8%), 고혈압(3.5%)이었다.
표 23. KEYNOTE ‑775의 자궁내막암 환자 중 20% 이상에서 보고된 이상사례
|
|
MSI-H 또는 dMMR이 없는 자궁내막암 | ||||||
| 이상사례 |
매 3주마다 이 약 200mg + 렌바티닙 n=342 |
독소루비신 또는 파클리탁셀 n=325 | |||||
|
모든 등급* (%) |
3-4 등급(%) |
모든 등급* (%) |
3-4 등급(%) | ||||
|
내분비 장애 | |||||||
|
갑상선 저하증† |
67 |
0.9 |
0.9 |
0 | |||
|
혈관 장애 | |||||||
|
고혈압‡ |
67 |
39 |
6 |
2.5 | |||
|
출혈성 이상반응§ |
25 |
2.6 |
15 |
0.9 | |||
|
전신 장애 | |||||||
|
피로¶ |
58 |
11 |
54 |
6 | |||
|
위장관 장애 | |||||||
|
설사# |
55 |
8 |
20 |
2.8 | |||
|
오심 |
49 |
2.9 |
47 |
1.5 | |||
|
구토 |
37 |
2.3 |
21 |
2.2 | |||
|
구내염Þ |
35 |
2.6 |
26 |
1.2 | |||
|
복통ß |
34 |
2.6 |
21 |
1.2 | |||
|
변비 |
27 |
0 |
25 |
0.6 | |||
|
근골격계 및 결합조직 장애 | |||||||
|
근골격 장애à |
53 |
5 |
27 |
0.6 | |||
|
대사 및 영양 장애 | |||||||
|
식욕 감소è |
44 |
7 |
21 |
0 | |||
|
임상 검사 | |||||||
|
체중 감소 |
34 |
10 |
6 |
0.3 | |||
|
신장 및 요로계 장애 | |||||||
|
단백뇨ð |
29 |
6 |
3.4 |
0.3 | |||
|
감염 | |||||||
|
요로감염ø |
31 |
5 |
13 |
1.2 | |||
|
신경계 장애 | |||||||
|
두통 |
26 |
0.6 |
9 |
0.3 | |||
|
호흡기, 흉부 및 종격동 장애 | |||||||
|
발성 장애 |
22 |
0 |
0.6 |
0 | |||
|
피부 및 피하조직 장애 | |||||||
|
손바닥-발바닥 홍반성 감각 이상 증후군ý |
23 |
2.9 |
0.9 |
0 | |||
|
발진£ |
20 |
2.3 |
4.9 |
0 | |||
<SUP>†</SUP>갑상선 저하증, 혈액 갑상선 자극 호르몬 증가, 갑상선염, 이차 갑상선 저하증 포함
<SUP>‡</SUP>고혈압, 혈압 증가, 이차 고혈압, 혈압 이상, 고혈압 뇌 병증, 혈압 변동 포함
<SUP>§</SUP>비출혈, 질 출혈, 혈뇨, 치은 출혈, 부정 자궁 출혈, 직장 출혈, 타박상, 혈변 배설, 뇌출혈, 결막 출혈, 위장관 출혈, 객혈, 요로관 출혈, 하부 위장관 출혈, 입 출혈, 점상 출혈, 자궁 출혈, 항문 출혈, 혈액 수포, 눈 출혈, 혈종, 두 개 내 출혈, 출혈성 뇌졸중, 흑색변, 스토마 부위 출혈, 상부 위장관 출혈, 상처 출혈, 혈뇨 존재, 반상 출혈, 토혈, 피하 출혈, 간 혈종, 주사 부위 타박상, 장의 출혈, 후두 출혈, 폐출혈, 경막하 혈종, 제대에서의 출혈, 혈관 천자 부위 타박상 포함
<SUP>¶</SUP>피로, 무력증, 병감(권태), 기면 포함
<SUP>#</SUP>설사, 위장염 포함
<SUP>Þ</SUP>구내염, 점막 염증, 구인두 통증, 아프타성 궤양, 입 궤양 형성, 입술염, 구강 점막 홍반, 혀 궤양 형성 포함
<SUP>ß</SUP>복통, 상복부 통증, 하복부 통증, 복부 불편감, 위장관 통증, 복부 압통, 상복부의 불편감 포함
<SUP>a</SUP>관절통, 근육통, 등허리 통증, 사지 통증, 골 통증, 경부 통증, 근골격 통증, 관절염, 근골격성 흉부 통증, 근골격 경직, 비 ‑심장성 흉통, 턱 통증
<SUP>e</SUP>식욕 감소, 조기 포만감 포함
<SUP>ð</SUP>단백뇨, 요단백 존재, 헤모글로빈뇨 포함
<SUP>ø</SUP>요로감염, 방광염, 신우신염 포함
<SUP>y</SUP>손바닥 ‑발바닥 홍반성 감각 이상 증후군, 손바닥 홍반, 발바닥 홍반 포함
<SUP>£</SUP>발진, 반상 ‑구진 발진, 소양성 발진, 홍반성 발진, 반상 발진, 농포성 발진, 구진 발진, 소수포성 발진, 적용부위 발진포함
표 24. KEYNOTE ‑775의 자궁내막암 환자 중 20% 이상(모든 등급) 또는 3% 이상(3 ‑4등급)에서 보고되고, 기저치*보다 악화된 임상검사치 이상
|
|
MSI-H 또는 dMMR이 없는 자궁내막암 | |||
|
임상검사† |
매 3주마다 이 약 200mg + 렌바티닙 n=342 |
독소루비신 또는 파클리탁셀 n=325 | ||
|
모든 등급‡ (%) |
3-4 등급(%) |
모든 등급‡ (%) |
3-4 등급(%) | |
|
화학적 검사 | ||||
|
고중성지방 혈증 |
70 |
6 |
45 |
1.7 |
|
저알부민 혈증 |
60 |
2.7 |
42 |
1.6 |
|
아스파르트산 아미노 전이 효소 증가 |
58 |
9 |
23 |
1.6 |
|
고혈당증 |
58 |
8 |
45 |
4.4 |
|
저마그네슘 혈증 |
53 |
6 |
32 |
3.8 |
|
알라닌 아미노 전이효소 증가 |
55 |
9 |
21 |
1.2 |
|
고콜레스테롤 혈증 |
53 |
3.2 |
23 |
0.7 |
|
저나트륨 혈증 |
46 |
15 |
28 |
7 |
|
알칼리 인산 분해 효소 증가 |
43 |
4.7 |
18 |
0.9 |
|
저칼슘 혈증 |
40 |
4.7 |
21 |
1.9 |
|
리파아제 증가 |
36 |
14 |
13 |
3.9 |
|
크레아티닌 증가 |
35 |
4.7 |
18 |
1.9 |
|
저칼륨 혈증 |
34 |
10 |
24 |
5 |
|
저인산 혈증 |
26 |
8 |
17 |
3.2 |
|
아밀라아제 증가 |
25 |
7 |
8 |
1 |
|
고칼륨 혈증 |
23 |
2.4 |
12 |
1.2 |
|
크레아틴 활성 효소 증가 |
19 |
3.7 |
7 |
0 |
|
빌리루빈 증가 |
18 |
3.6 |
6 |
1.6 |
|
혈액학적 검사 | ||||
|
림프구 감소증 |
50 |
16 |
65 |
20 |
|
혈소판 감소증 |
50 |
8 |
30 |
4.7 |
|
빈혈 |
49 |
8 |
84 |
14 |
|
백혈구 감소증 |
43 |
3.5 |
83 |
43 |
|
중성구 감소증 |
31 |
6 |
76 |
58 |
<SUP>†</SUP>시험 기저치가 확인되고 최소 1회 이상 임상검사치 측정이 가능했던 환자에 대해 각 시험별 발생률을 계산하였다: 이 약/렌바티닙(범위:263 ‑340명), 독소루비신 또는 파클리탁셀(범위:240 ‑322명)
<SUP>‡</SUP>NCI CTCAE v4.03에 따라 등급을 매겼다.
삼중음성 유방암
KEYNOTE ‑522: 고위험 조기 삼중음성 유방암 환자 대상의 수술 전 보조요법(neoadjuvant) 및 수술 후 보조요법(adjuvant) 대조 임상시험
이 약을 투여받은 환자의 0.9%에서 다발성 장기 기능 부전, 심근 경색, 쇼크 및 원인 불명의 사망과 관련이 있는 자가 면역 뇌염, 폐렴, 폐염증, 폐 색전증, 그리고 패혈증을 포함한 치명적인 이상사례가 발생하였다. 이 약을 투여받은 환자의 44%에서 중대한 이상사례가 발생하였으며, 2% 이상에서 발생한 중대한 이상사례는 발열성 중성구 감소증(15%), 발열(3.7%), 빈혈(2.6%), 그리고 중성구 감소증(2.2%)이다. 이 약의 일시 중단으로 이어진 가장 빈번한 이상사례( ≧2%)는 중성구 감소증(26%), 혈소판 감소증(6%), ALT 증가(6%), AST 증가(3.7%), 빈혈(3.5%), 발진(3.2%), 발열성 중성구 감소증(2.8%), 백혈구 감소증(2.8%), 상기도 감염(2.6%), 발열(2.2%), 그리고 피로(2.1%)였다.
표 25 및 표 26은 KEYNOTE ‑522에 참여해 이 약으로 치료받은 환자에서 발생한 이상사례 및 임상검사치 이상을 각각 요약한 것이다.
표 25. 이 약을 투여 받은 환자 중 20% 이상의 환자에서 발생한 이상사례 (KEYNOTE ‑522)
| 이상사례 |
화학요법*과 병용하여 이 약 200 mg 매 3주에 1회 / 이 약 n=778 |
화학요법*과 병용하여 위약 / 위약 n=389 | ||
|
모든 등급† (%) |
3-4 등급 (%) |
모든 등급† (%) |
3-4 등급 (%) | |
|
전신 장애 | ||||
|
피로‡ |
70 |
8 |
66 |
3.9 |
|
발열 |
28 |
1.3 |
19 |
0.3 |
|
위장관 장애 | ||||
|
오심 |
67 |
3.7 |
66 |
1.8 |
|
변비 |
42 |
0 |
39 |
0.3 |
|
설사 |
41 |
3.2 |
34 |
1.8 |
|
구내염§ |
34 |
2.7 |
29 |
1 |
|
구토 |
31 |
2.7 |
28 |
1.5 |
|
복통¶ |
24 |
0.5 |
23 |
0.8 |
|
피부 및 피하 조직 장애 | ||||
|
탈모 |
61 |
0 |
58 |
0 |
|
발진# |
52 |
5 |
41 |
0.5 |
|
신경계 장애 | ||||
|
말초 신경 병증Þ |
41 |
3.3 |
42 |
2.3 |
|
두통 |
30 |
0.5 |
29 |
1 |
|
근골격 및 결합 조직 장애 | ||||
|
관절통 |
29 |
0.5 |
31 |
0.3 |
|
근육통 |
20 |
0.5 |
19 |
0 |
|
호흡기, 흉곽 및 종격 장애 | ||||
|
기침ß |
26 |
0.1 |
24 |
0 |
|
대사 및 영양 장애 | ||||
|
식욕 감소 |
23 |
0.9 |
17 |
0.3 |
|
정신 장애 | ||||
|
불면 |
21 |
0.5 |
19 |
0 |
|
*화학요법: 카보플라틴 및 파클리탁셀에 이어 독소루비신 또는 에피루비신 및 사이클로포스파마이드 †NCI CTCAE v4.0에 따라 등급을 매겼다. ‡무력증, 피로를 포함한다. §아프타성 궤양, 입술염, 입술 통증, 입술 궤양 형성, 입 궤양 형성, 점막 염증, 구강 점막 발진, 구강 통증, 구내염, 혀 물집 형성, 혀 궤양 형성을 포함한다. ¶복부 불편감, 복통, 하복부 통증, 상복부 통증, 복부 압통을 포함한다. #피부염, 여드름양 피부염, 알레르기성 피부염, 수포성 피부염, 전신 탈락 피부염, 약물 발진, 습진, 절개 부위 발진, 주사 부위 발진, 발진, 홍반성 발진, 모낭성 발진, 반상 발진, 반상-구진 발진, 홍역양 발진, 구진 발진, 소양성 발진, 농포성 발진, 풍진양 발진, 피부 탈락, 피부 독성, 독성 피부 발진, 두드러기, 혈관염성 발진, 바이러스 발진을 포함한다. Þ말초 신경 병증, 운동 말초 신경 병증, 감각 운동 말초 신경 병증, 말초 감각 신경 병증을 포함한다. ß기침, 습성 기침, 상-기도 기침 증후군을 포함한다. | ||||
|
임상 검사* |
화학요법†과 병용하여 이 약 200 mg 매 3주에 1회 / 이 약 |
화학요법†과 병용하여 위약 / 위약 | ||
|
모든 등급‡ (%) |
3-4 등급 (%) |
모든 등급‡ (%) |
3-4 등급 (%) | |
|
혈액학적 검사 | ||||
|
빈혈 |
97 |
22 |
96 |
19 |
|
백혈구 감소증 |
93 |
41 |
91 |
32 |
|
중성구 감소증 |
88 |
62 |
89 |
62 |
|
림프구 감소증 |
80 |
28 |
74 |
22 |
|
혈소판 감소증 |
58 |
11 |
57 |
9 |
|
화학적 검사 | ||||
|
ALT 증가 |
71 |
9 |
69 |
4.6 |
|
AST 증가 |
66 |
6 |
58 |
1.8 |
|
고혈당증 |
65 |
5 |
62 |
2.8 |
|
알칼리 인산 분해 효소 증가 |
41 |
1 |
37 |
0.8 |
|
저나트륨 혈증 |
38 |
9 |
28 |
6 |
|
저알부민 혈증 |
36 |
1.2 |
30 |
1.5 |
|
저칼슘 혈증 |
32 |
3.2 |
29 |
4.4 |
|
저칼륨 혈증 |
32 |
6 |
24 |
2.8 |
|
저인산 혈증 |
23 |
6 |
18 |
4.5 |
|
고칼슘 혈증 |
21 |
3 |
24 |
3.4 |
|
*시험 기저치가 확인되고 최소 1회 이상 임상검사치 측정이 가능했던 환자에 대해 각 시험별 발생률을 계산하였다: 이 약과 화학요법 병용투여 후 이 약 단독투여 (범위: 759-777명), 위약과 화학요법 병용투여 후 위약 (범위: 378-389명). †화학요법: 카보플라틴 및 파클리탁셀에 이어 독소루비신 또는 에피루비신 및 사이클로포스파마이드 ‡NCI CTCAE v4.0에 따라 등급을 매겼다. | ||||
이 약의 안전성은 전이 단계에서 이전에 화학요법을 받지 않은 수술이 불가능한 국소 재발성 또는 전이성 삼중음성 유방암 환자를 등록한 다기관, 이중맹검, 무작위화(2:1), 위약 대조 임상시험인 KEYNOTE ‑355에서 파클리탁셀, 알부민결합 파클리탁셀 또는 젬시타빈 및 카보플라틴과의 병용요법으로 조사되었다(14.임상시험 정보 항 참고). 총 596명의 환자(안전성 준비기간 내 34명 포함)는 파클리탁셀, 알부민결합 파클리탁셀 또는 젬시타빈 및 카보플라틴과의 병용요법으로 이 약 200mg을 매 3주 투약하였다.
심폐 ‑정지(0.7%)와 패혈성 쇼크(0.3%)를 포함하는 치명적 이상사례는 이 약과 화학요법제를 병용한 환자의 2.5%에서 발생하였다.
중대한 이상사례는 이 약과 파클리탁셀, 알부민결합 파클리탁셀 또는 젬시타빈 및 카보플라틴을 병용한 환자의 30%에서 발생하였다. 환자의 2% 이상 발생한 중대한 이상사례는 폐렴 (2.9%), 빈혈 (2.2%), 그리고 혈소판 감소증 (2%)이었다.
환자의 11%가 이상사례로 이 약 투여를 중단하였다. 이 약의 영구 중단으로 이어진 가장 빈번한 이상사례( ≧1%)는 ALT 증가 (2.2%), AST 증가 (1.5%), 그리고 폐염증 (1.2%)이었다. 이 약의 일시 중단으로 이어진 이상사례는 환자의 50%에서 발생하였다. 이 약의 일시 중단으로 이어진 가장 빈번한 이상사례( ≧2%)는 중성구 감소증 (22%), 혈소판 감소증 (14%), 빈혈 (7%), ALT 증가 (6%), 백혈구 감소증 (5%), AST 증가 (5%), 백혈구 수 감소 (3.9%), 그리고 설사(2%)였다.
표 27 및 표 28은 KEYNOTE ‑355에 참여해 이 약으로 치료받은 환자에서 발생한 이상사례 및 임상검사치 이상을 요약한 것이다.
표 27. 이 약과 화학요법제를 투여받은 환자 중 20% 이상의 환자에서 발생한 이상사례 (KEYNOTE ‑355)
| 이상사례 |
이 약 200mg 매 3주에 1회 + 화학요법제 n=596 |
위약 매 3주에 1회 + 화학요법제 n=281 | ||
|
모든 등급* (%) |
3-4 등급(%) |
모든 등급* (%) |
3-4 등급(%) | |
|
전신 장애 | ||||
|
피로† |
48 |
5 |
49 |
4.3 |
|
위장관 장애 | ||||
|
오심 |
44 |
1.7 |
47 |
1.8 |
|
설사 |
28 |
1.8 |
23 |
1.8 |
|
변비 |
28 |
0.5 |
27 |
0.4 |
|
구토 |
26 |
2.7 |
22 |
3.2 |
|
피부 및 피하 조직 장애 | ||||
|
탈모증 |
34 |
0.8 |
35 |
1.1 |
|
발진‡ |
26 |
2 |
16 |
0 |
|
호흡기, 흉곽 및 종격 장애 | ||||
|
기침§ |
23 |
0 |
20 |
0.4 |
|
대사 및 영양 장애 | ||||
|
식욕 감소 |
21 |
0.8 |
14 |
0.4 |
|
신경계 장애 | ||||
|
두통¶ |
20 |
0.7 |
23 |
0.7 |
|
*NCI CTCAE v4.03 에 따라 등급을 매겼다. †피로, 무력증을 포함한다. ‡발진, 반상-구진 발진, 소양성 발진, 농포성 발진, 반상 발진, 구진 발진, 나비 모양 발진, 홍반성 발진, 눈꺼풀 발진을 포함한다 §기침, 습성 기침, 상-기도 기침 증후군을 포함한다. ¶두통, 편두통, 긴장성 두통을 포함한다. | ||||
|
임상 검사 |
이 약 200mg 매 3주에 1회 + 화학요법제
|
위 약 매 3주에 1회 + 화학요법제
| ||
|
모든 등급† % |
3-4 등급 % |
모든 등급† % |
3-4 등급 % | |
|
혈액학적 검사 | ||||
|
빈혈 |
90 |
20 |
85 |
19 |
|
백혈구 감소증 |
85 |
39 |
86 |
39 |
|
중성구 감소증 |
76 |
49 |
77 |
52 |
|
림프구 감소증 |
70 |
26 |
70 |
19 |
|
혈소판 감소증 |
54 |
19 |
53 |
21 |
|
화학적 검사 | ||||
|
ALT 증가 |
60 |
11 |
58 |
8 |
|
AST 증가 |
57 |
9 |
55 |
6 |
|
고혈당증 |
52 |
4.4 |
51 |
2.2 |
|
저알부민 혈증 |
37 |
2.2 |
32 |
2.2 |
|
알칼리 인산 분해 효소 증가 |
35 |
3.9 |
39 |
2.2 |
|
저칼슘 혈증 |
29 |
3.3 |
27 |
1.8 |
|
저나트륨 혈증 |
28 |
5 |
26 |
6 |
|
저인산 혈증 |
21 |
7 |
18 |
4.8 |
|
저칼륨 혈증 |
20 |
4.4 |
18 |
4.0 |
|
*시험 기저치가 확인되고 최소 1회 이상 임상검사치 측정이 가능했던 환자에 대해 각 시험별 발생률을 계산하였다: 이 약+화학요법제 (범위: 566-592 명), 위약 + 화학요법제 (범위: 269-280명). †NCI CTCAE v4.03에 따라 등급을 매겼다. | ||||
화학방사선요법(CRT)(시스플라틴 및 외부 빔 방사선 요법[EBRT] 후 근접치료[BT])과 병용한 이 약의 안전성은 FIGO 2014 III ‑IVA기 자궁경부암 환자 594명을 포함한 임상시험인 위약 대조, 무작위(1:1), 다기관, 이중 맹검 임상시험 KEYNOTE ‑A18에서 조사되었다. 총 292명의 환자가 이 약을 화학방사선요법과 병용하여 투여받았으며 총 302명의 환자가 위약을 화학방사선요법과 병용하여 투여받았다.
이 약의 노출 중앙값은 12.1개월(범위: 1일 ‑27개월)이었다.
치명적인 이상사례는 이 약과 화학방사선요법을 병용하여 투여받은 환자의 1.4%에서 발생하였고, 대장 천공, 요로성 패혈증, 패혈증 및 질 출혈 각각 1건씩(0.3%)을 포함하였다.
중대한 이상사례는 이 약과 화학방사선요법을 병용하여 투여받은 환자의 30%에서 발생하였다. 환자의 1% 이상에서 발생한 중대한 이상사례는 요로 감염(2.7%), 요로성 패혈증(1.4%) 및 패혈증(1%)을 포함하였다.
이상사례로 인한 이 약의 투여중단은 환자의 7%에서 발생하였다. 영구적인 투여중단을 야기한 가장 빈번한 이상사례( ≧1%)는 설사(1%)이었다.
이상사례로 인한 이 약의 일시 중단은 환자의 43%에서 발생하였다; 일시적인 투여중단을 야기한 가장 빈번한 이상사례 ( ≧2%)는 빈혈(8%), COVID ‑19(6%), SARS ‑CoV ‑2 시험 양성(3.1%), 중성구 수 감소(2.7%), 설사(2.7%), 요로 감염(2.7%) 및 ALT 증가(2.4%)이었다.
표 29 및 표 30은 KEYNOTE ‑A18에서 이 약으로 치료받은 환자에서 발생한 이상사례와 임상검사치 이상을 각각 요약한 것이다.
표 29. 이 약을 투여받은 FIGO 2014 III ‑IVA기 자궁경부암 환자 중 10% 이상의 환자에서 발생한 이상사례(KEYNOTE ‑A18)
|
이상사례 |
화학방사선요법과 이 약 매 3주마다 200 mg 병용 및 이 약 매 6주마다 400 mg n=292 |
화학방사선요법과 위약
n=302 | ||
|
모든 등급* (%) |
3-4등급(%) |
모든 등급* (%) |
3-4등급(%) | |
|
위장관 장애 | ||||
|
오심 |
56 |
0 |
61 |
2.3 |
|
설사 |
50 |
3.8 |
50 |
4.3 |
|
구토 |
33 |
1 |
34 |
1.7 |
|
변비 |
18 |
0 |
18 |
0.7 |
|
복통 |
12 |
0.7 |
12 |
1.7 |
|
감염 | ||||
|
요로 감염† |
32 |
4.1 |
31 |
4.6 |
|
전신 장애 | ||||
|
피로‡ |
26 |
1 |
27 |
1.3 |
|
발열 |
12 |
0.3 |
13 |
0 |
|
내분비 장애 | ||||
|
갑상선 저하증§ |
20 |
0.7 |
5 |
0 |
|
갑상선 항진증 |
11 |
0.3 |
2.6 |
0 |
|
대사 및 영양 장애 | ||||
|
식욕 감소 |
17 |
0.7 |
17 |
0.3 |
|
임상 검사 | ||||
|
체중 감소 |
17 |
1.4 |
18 |
1 |
|
신장 및 요로계 장애 | ||||
|
배뇨 곤란 |
11 |
0.3 |
12 |
0 |
|
피부 및 피하조직 장애 | ||||
|
발진¶ |
11 |
0.7 |
7 |
0.3 |
|
생식계 장애 | ||||
|
골반 통증 |
10 |
1 |
13 |
1.3 |
† 요로 감염, 슈도모나스 요로 감염, 급성 신우신염, 방광염, 대장균 요로 감염을 포함한다.
‡ 피로, 무력증을 포함한다.
§ 갑상선 저하증, 자가 면역성 갑상선 저하증을 포함한다.
¶ 다형성 홍반, 피부염, 약물 발진, 습진, 발진, 피부 탈락, 수포성 피부염, 반상 ‑구진 발진, 편평 태선, 발한 이상 습진, 여드름양 피부염을 포함한다.
표 30. 이 약을 투여받은 FIGO 2014 III ‑IVA기 자궁경부암 환자 중 20% 이상의 환자에서 발생한 기저치보다 악화된 임상검사치 이상(KEYNOTE ‑A18)
|
임상검사* |
화학방사선요법과 이 약 매 3주마다 200 mg 병용 및 이 약 매 6주마다 400 mg |
화학방사선요법과 위약 | ||
|
모든 등급† (%) |
3-4등급(%) |
모든 등급† (%) |
3-4등급(%) | |
|
혈액학적 검사 | ||||
|
림프구 감소증 |
99 |
96 |
99 |
92 |
|
백혈구 감소증 |
96 |
46 |
94 |
49 |
|
빈혈 |
88 |
31 |
81 |
25 |
|
중성구 감소증 |
75 |
32 |
74 |
33 |
|
혈소판 감소증 |
65 |
8 |
61 |
6 |
|
화학적 검사 | ||||
|
저마그네슘 혈증 |
59 |
4.2 |
63 |
3.4 |
|
저나트륨 혈증 |
54 |
3.8 |
47 |
4 |
|
AST 증가 |
45 |
1 |
39 |
1.7 |
|
ALT 증가 |
44 |
2.1 |
44 |
1 |
|
저칼슘 혈증 |
43 |
4.8 |
40 |
4.3 |
|
저칼륨 혈증 |
42 |
14 |
38 |
10 |
|
크레아티닌 증가 |
41 |
6 |
43 |
6 |
|
저알부민 혈증 |
37 |
0.7 |
35 |
1.7 |
|
알칼리 인산 분해 효소 증가 |
34 |
0.3 |
33 |
0.3 |
† NCI CTCAE v5.0에 따라 등급을 매겼다.
이전에 항암화학요법 치료 경험이 없는 지속성, 재발성 또는 전이성 자궁경부암 환자를 대상으로 이 약 또는 위약을 베바시주맙을 포함하거나 포함하지 않은 항암화학요법과 병용한 다기관, 이중 맹검, 무작위 배정(1:1) 임상시험인 KEYNOTE ‑826에서 조사되었다. 총 616명의 환자가 이 약 200mg과 항암화학요법(n=307) 또는 위약과 항암화학요법(n=309)을 매 3주마다 투여 받았다.
치명적인 이상사례는 이 약과 베바시주맙을 포함하거나 포함하지 않는 항암화학요법의 병용요법군에서 4.6% 발생하였고 이는 출혈 3건, 패혈증 2건, 원인 불명 2건을 포함하여, 급성 심근 경색, 자가 면역 뇌염, 심정지, 뇌혈관 사고, 수술 후 폐 색전을 동반한 대퇴골 골절, 장 천공 및 골반 감염 각 1건씩이었다.
중대한 이상사례는 이 약과 베바시주맙을 포함하거나 포함하지 않는 항암화학요법의 병용요법군에서 50% 발생하였다. 환자의 3% 이상에서 발생한 중대한 이상사례는 발열성 중성구 감소증(6.8%), 요로 감염(5.2%), 빈혈(4.6%), 급성 신 손상(3.3%) 및 패혈증(3.3%)이었다. 표 31 및 표 32는 KEYNOTE ‑826에서 이 약으로 치료받은 환자에서 발생한 이상사례 및 임상검사치 이상을 요약한 것이다.
표 31. 이 약을 투여받은 환자 중 20% 이상의 환자에서 발생한 이상사례(KEYNOTE ‑826)
| 이상사례 |
매 3주마다 이 약 200mg + 항암화학요법* (±베바시주맙) n=307 |
위약 + 항암화학요법* (±베바시주맙) n=309 | ||
|
모든 등급† (%) |
3-4등급 (%) |
모든 등급† (%) |
3-4등급 (%) | |
|
신경계 장애 | ||||
|
말초 신경 병증‡ |
58 |
4.2 |
57 |
6 |
|
피부 및 피하 조직 장애 | ||||
|
탈모 |
56 |
0 |
58 |
0 |
|
발진§ |
22 |
3.6 |
15 |
0.3 |
|
전신 장애 | ||||
|
피로¶ |
47 |
7 |
46 |
6 |
|
위장관 장애 | ||||
|
오심 |
40 |
2 |
44 |
1.6 |
|
설사 |
36 |
2 |
30 |
2.6 |
|
변비 |
28 |
0.3 |
33 |
1 |
|
구토 |
26 |
2.6 |
27 |
1.9 |
|
근골격 및 결합 조직 장애 | ||||
|
관절통 |
27 |
0.7 |
26 |
1.3 |
|
혈관 장애 | ||||
|
고혈압 |
24 |
9 |
23 |
11 |
|
감염 | ||||
|
요로 감염 |
24 |
9 |
26 |
8 |
<SUP>†</SUP>NCI CTCAE v4.0에 따라 등급을 매겼다.
<SUP>‡</SUP>말초 신경 병증, 말초 감각 신경 병증, 말초 운동 신경 병증, 감각 운동 말초 신경 병증, 지각 이상을 포함한다.
<SUP>§</SUP>발진, 반상 ‑구진 발진, 홍반성 발진, 반상 발진, 구진 발진, 소양성 발진, 농포성 발진을 포함한다.
<SUP>¶</SUP>피로, 무력증을 포함한다.
표 32. 이 약을 투여받은 환자 중 20% 이상의 환자에서 발생한 기저치보다 악화된 임상검사치 이상(KEYNOTE ‑826)
|
임상검사* |
매 3주마다 이 약 200mg + 항암화학요법†(±베바시주맙) n=307 |
위약 + 항암화학요법†(±베바시주맙) n=309 | ||
|
모든 등급‡ (%) |
3-4등급 (%) |
모든 등급‡ (%) |
3-4등급 (%) | |
|
혈액학적 검사 | ||||
|
빈혈 |
80 |
35 |
77 |
33 |
|
백혈구 감소증 |
76 |
27 |
69 |
19 |
|
중성구 감소증 |
66 |
39 |
58 |
31 |
|
림프구 감소증 |
61 |
33 |
56 |
33 |
|
혈소판 감소증 |
57 |
19 |
53 |
15 |
|
화학적 검사 | ||||
|
고혈당증 |
51 |
4.7 |
46 |
2.3 |
|
저알부민 혈증 |
46 |
1.3 |
38 |
5 |
|
저나트륨 혈증 |
40 |
14 |
38 |
11 |
|
ALT 증가 |
40 |
7 |
38 |
6 |
|
AST 증가 |
40 |
6 |
36 |
3.0 |
|
알칼린 인산 분해 효소 증가 |
38 |
3.4 |
40 |
2.3 |
|
저칼슘 혈증 |
37 |
4.0 |
31 |
5 |
|
크레아티닌 증가 |
34 |
5 |
32 |
6 |
|
저칼륨 혈증 |
29 |
7 |
26 |
7 |
|
고칼륨 혈증 |
23 |
3.7 |
27 |
4.7 |
|
고칼슘 혈증 |
21 |
1.0 |
20 |
1.3 |
<SUP>†</SUP>항암화학요법(파클리탁셀과 시스플라틴 또는 파클리탁셀과 카보플라틴)
<SUP>‡</SUP>NCI CTCAE v4.0에 따라 등급을 매겼다.
담도암
이 약과 젬시타빈 및 시스플라틴과의 병용요법에 대한 안전성은 이전에 진행성 질환에 대한 전신 치료 경험이 없는 수술이 불가능한 국소 진행성 또는 전이성 담도암 환자를 대상으로 한 다기관, 이중 맹검, 무작위 배정, 위약 대조연구 임상시험인 KEYNOTE ‑966에서 조사되었다. 총 1,063명의 환자가 이 약 200mg과 젬시타빈 및 시스플라틴(n=529) 또는 위약과 젬시타빈 및 시스플라틴(n=534)을 매 3주마다 투여 받았다. 이 약에 대한 노출기간 중앙값은 6개월(범위: 1일 ‑28개월)이었다.
이상사례로 인한 이 약의 투여중단은 환자의 15%에서 발생하였다. 영구적인 투여중단을 야기한 가장 빈번한( ≧1%) 이상사례는 폐염증(1.3%) 이었다. 이상사례로 인한 이 약의 일시 중단은 환자의 55%에서 발생하였다. 일시적인 투여중단을 야기한 가장 빈번한( ≧2%) 이상사례 또는 임상검사치 이상은 호중구 수 감소(18%), 혈소판 수 감소(10%), 빈혈(6%), 백혈구 수 감소(4%), 발열(3.8%), 피로(3.0%), 담관염(2.8%). ALT 증가(2.6%), AST 증가(2.5%), 및 담도 폐쇄(2.3%)였다.
이 약과 항암화학요법의 병용투여와 위약과 항암화학요법의 병용 투여를 비교하였을 때, 이 약 투여환자와 위약 투여 환자 간에 5% 이상의 발생률 차이를 보인 이상사례는 발열 (26% vs. 20%), 발진 (21% vs. 13%), 소양증 (15% vs. 10%) 및 갑상선 저하증 (9% vs. 2.6%)였다. 두 군 간에 3 ‑4등급 독성의 발생률에는 임상적으로 의미 있는 차이가 확인되지 않았다. 이 약과 항암화학요법 병용 투여환자와 위약과 항암화학요법 병용 투여 환자 간에 5% 이상의 발생률 차이를 보인 임상검사치 이상은 림프구 감소(69% vs. 61%)였다. 두 군 간에 3 ‑4등급 독성의 발생률에는 임상적으로 의미 있는 차이가 확인되지 않았다.
간세포암
이 약의 안전성은 이전에 치료 경험이 있는 간세포암을 대상으로 한 다기관, 이중 맹검, 무작위 배정, 위약 대조 연구인 KEYNOTE ‑394에서 조사되었다. 환자는 무작위 배정(2:1)되어 이 약 200mg(n=299) 또는 위약(n=153)을 최대 35주기까지 매 3주마다 투여 받았다.
이 약에 대한 노출기간 중앙값은 3.3개월(범위: 1일 ‑27.3개월)이었고, 위약에 대한 노출기간의 중앙값은 2.2개월(범위: 1일 ‑15.5개월)이었다. 이상사례로 인한 이 약의 투여중단은 환자의 13%에서 발생하였다. 영구적인 투여중단을 야기한 가장 빈번한 이상사례는 복수(2.3%)였다. 이상사례로 인한 이 약의 일시 중단은 환자의 26%에서 발생하였다. 일시적인 투여중단을 야기한 가장 빈번한( ≧2%) 이상사례 또는 임상검사치 이상은 혈중 빌리루빈 증가(9%), AST 증가(5%), 및 ALT 증가(2%)였다.
표 33 및 표 34는 KEYNOTE ‑394에서 이 약으로 치료받은 환자에서 발생한 이상사례 및 임상검사치 이상을 요약한 것이다.
표 33. KEYNOTE ‑394에서 이 약을 투여받은 환자 중 10% 이상의 환자에서 발생한 이상사례
|
이상사례 |
매 3주마다 이 약 200mg n=299 |
위약 n=153 | ||
|
모든 등급*† (%) |
3-4등급 (%) |
모든 등급† (%) |
3-4등급 (%) | |
|
일반 | ||||
|
발열 |
18 |
0.7 |
14 |
0 |
|
피부 및 피하 조직 장애 | ||||
|
발진† |
18 |
0.7 |
7 |
0 |
|
소양증 |
12 |
0 |
4 |
0 |
|
위장관 장애 | ||||
|
설사 |
16 |
1.7 |
9 |
0 |
|
대사 및 영양 | ||||
|
식욕 감퇴 |
15 |
0.3 |
9 |
0 |
|
감염 | ||||
|
상기도 감염 |
11 |
1.0 |
7 |
0.7 |
|
호흡, 중격동 장애 | ||||
|
기침 |
11 |
0 |
9 |
0 |
|
내분비 | ||||
|
갑상선 저하증 |
10 |
0 |
7 |
0 |
<SUP>† </SUP>피부염, 알러지성 피부염, 수포성 피부염, 발진, 홍반성 발진, 반상 ‑구진 발진, 농포성 발진, 수포를 포함한다.
표 34. KEYNOTE ‑394에서 이 약을 투여받은 환자 중 20% 이상의 환자에서 발생한 기저치보다 악화된 임상검사치 이상
|
임상검사* |
매 3주마다 이 약 200mg |
위약 | ||
|
모든 등급† (%) |
3-4등급 (%) |
모든 등급† (%) |
3-4등급 (%) | |
|
화학적 검사 | ||||
|
AST 증가 |
54 |
14 |
44 |
12 |
|
빌리루빈 증가 |
47 |
11 |
36 |
7 |
|
ALT 증가 |
47 |
7 |
32 |
4.6 |
|
감마-글루타밀 전이 효소(GGT) 증가 |
40 |
20 |
39 |
15 |
|
저알부민 혈증 |
40 |
0.7 |
20 |
0.7 |
|
알칼린 인산 분해 효소 증가 |
39 |
4.1 |
34 |
4 |
|
고혈당증 |
36 |
3.3 |
26 |
1.4 |
|
저나트륨 혈증 |
36 |
11 |
28 |
5 |
|
저인산 혈증 |
30 |
6 |
17 |
4 |
|
저칼슘 혈증 |
24 |
1.4 |
15 |
0.7 |
|
혈액학적 검사 | ||||
|
림프구 감소증 |
44 |
11 |
34 |
4.6 |
|
빈혈 |
36 |
7 |
30 |
3.3 |
|
혈소판 수 감소 |
32 |
4.7 |
29 |
2 |
|
백혈구 감소증 |
30 |
1.3 |
21 |
0.7 |
|
중성구 감소증 |
25 |
4.4 |
21 |
2 |
<SUP>† </SUP>NCI CTCAE v4.03에 따라 등급을 매겼다.
2) 시판 후 이상사례
이 약의 시판 후 사용 동안 아래와 같은 이상사례가 확인되었다. 이러한 이상사례는 불특정한 인구에서 자발적으로 보고되었기 때문에 발생빈도를 확실히 추정하거나 이 약 노출과의 상관관계를 확립하기 어렵다.
‑ 눈 장애: 보그트 ‑고야나기 ‑하라다 증후군
‑ 면역계 장애: 혈구 탐식성 림프 조직구증
‑ 신경계 장애: 시신경염
3) 면역 ‑매개 약물이상반응
흑색종 및 비소세포폐암 환자 2799명에 대한 면역 ‑매개 약물이상반응을 제시하였다. 두 암종 간 안전성 프로파일은 유사하였다. 표 35에 이 약을 투여한 환자에서 확인된 면역 ‑매개 약물이상반응을 등급에 따라 정리하였다.
표 35. 면역 ‑매개 약물이상반응
|
|
이 약 2 mg/kg 매 3주에 1회 또는 10 mg/kg 매 2주 또는 3주에 1회 n=2799 | ||||
|
약물이상반응 |
모든 등급(%) |
2등급(%) |
3등급(%) |
4등급(%) |
5등급(%) |
|
갑상선 저하증* |
8.5 |
6.2 |
0.1 |
0 |
0 |
|
갑상선기능항진증† |
3.4 |
0.8 |
0.1 |
0 |
0 |
|
폐염증‡ |
3.4 |
1.3 |
0.9 |
0.3 |
0.1 |
|
결장염 |
1.7 |
0.4 |
1.1 |
<0.1 |
0 |
|
부신 부전 |
0.8 |
0.3 |
0.3 |
<0.1 |
0 |
|
간염 |
0.7 |
0.1 |
0.4 |
<0.1 |
0 |
|
뇌하수체염 |
0.6 |
0.2 |
0.3 |
<0.1 |
0 |
|
신장염§ |
0.3 |
0.1 |
0.1 |
<0.1 |
0 |
|
제 1형 당뇨병 |
0.2 |
<0.1 |
0.1 |
0.1 |
0 |
|
*이 약을 단독 요법으로 투여받은 두경부 편평상피세포암 환자(n=909)에 대한 개별 연구에서 갑상선 저하증의 발생률은 16.1%(모든 등급)였으며, 3등급의 발생률은 0.3%였다. 이 약을 백금 및 5-FU화학요법제와 병용 요법으로 투여받은 두경부 편평상피세포암 환자(n=276)에서 갑상선 저하증의 발생률은 15.2%(1등급 또는 2등급)였다. 전형적 호지킨림프종 환자(n=389)에서 갑상선 저하증의 발생률은 17%(1등급 또는 2등급)였다. 이 약을 단독 요법으로 투여받은 절제술을 시행한 신세포암 환자(n=488)에 대한 보조요법 연구에서 갑상선 저하증의 발생률은 21%(모든 등급)였으며, 3등급의 발생률은 0.2%였다. †이 약을 단독 요법으로 투여받은 절제술을 시행한 신세포암 환자(n=488)에 대한 보조요법 연구에서 갑상선기능항진증의 발생률은 12%(모든 등급)였으며, 3등급의 발생률은 0.2%였다. ‡이 약을 단독 요법으로 투여 받은 비소세포폐암 환자(총 n=2602)에 대한 개별 연구에서 폐염증의 발병률(모든 등급)은 3.8% ~ 8.3%의 범위를 나타냈다. 이 약을 단독으로 투여받은 전형적 호지킨 림프종 환자에서 폐염증(모든 등급)의 발생률은 KEYNOTE-087(n=210)과 KEYNOTE-204(n=148)에서 각각 5.2%~10.8%의 범위를 나타냈다. §이 약 200mg과 페메트렉시드 및 백금 화학요법제를 병용하여 투여받은 비편평 비소세포폐암 환자(n=405)에서 신장염의 발생률은 1.7%(모든 등급)였으며, 3등급의 발생률은 1.0%, 4등급의 발생률은 0.5%였다. | |||||
부신 부전이 발병하는 시간의 중앙값은 5.3개월(범위: 26일 ~ 16.6개월)이었다. 지속기간의 중앙값은 아직 도달하지 않았다(범위: 4일 ~ 1.9+년). 부신 부전으로 인해 이 약을 중단한 환자는 1명(<0.1%)이었다. 5명의 환자는 부신 부전 증상으로부터 회복하였다. 뇌하수체염이 발병하는 시간의 중앙값은 3.7개월(범위 : 1일 ~ 11.9개월)이었다. 지속기간의 중앙값은 4.7개월(범위 : 8+일 ~ 12.7+개월)이었다. 뇌하수체염으로 인해 이 약을 중단한 환자는 4명(0.1%)이었다. 7명의 환자는 뇌하수체염 증상으로부터 회복하였다. 갑상선기능항진증이 발병하는 시간의 중앙값은 2.1개월(범위: 3일 ~ 15.0+개월)이었다. 지속기간의 중앙값은 1.8개월(범위: 1일 ~ 12.8개월)이었다.
갑상선기능항진증으로 인해 이 약을 중단한 환자는 2명(<0.1%)이었다. 71명의 환자는 갑상선기능항진증 증상으로부터 회복하였다. 갑상선 저하증이 발병하는 시간의 중앙값은 3.5개월(범위: 1일 ~ 18.9개월)이었다. 지속기간의 중앙값은 아직 도달하지 않았다(범위: 2일 ~ 27.7+개월). 갑상선 저하증으로 이 약을 중단한 환자는 1명(<0.1%)이었다.
폐염증
폐염증이 발병하는 시간의 중앙값은 3.3개월(범위: 2일 ~ 19.3개월)이었다. 지속기간의 중앙값은 1.5개월(범위: 1일 ~ 17.2+개월)이었다. 폐염증으로 인해 이 약을 중단한 환자는 36명(1.3%)이었다. 55명의 환자는 폐염증 증상으로부터 회복하였다.
결장염
결장염이 발병하는 시간의 중앙값은 3.5개월(범위: 10일 ~ 16.2개월)이었다. 지속기간의 중앙값은 1.3개월(범위: 1일 ~ 8.7+개월)이었다. 결장염으로 인해 이 약을 중단한 환자는 15명(0.5%)이었다. 41명의 환자는 결장염 증상으로부터 회복하였다.
간염
간염이 발병하는 시간의 중앙값은 1.3개월(범위: 8일 ~ 21.4개월)이었다. 지속기간의 중앙값은 1.8 개월(범위: 8일 ~ 20.9+개월)이었다. 간염으로 인해 이 약을 중단한 환자는 6명(0.2%)이었다. 15명의 환자는 간염 증상으로부터 회복하였다.
신장염
신장염이 발병하는 시간의 중앙값은 5.1개월(범위: 12일 ~ 12.8개월)이었다. 지속기간의 중앙값은 3.3개월(범위: 12일 ~ 8.9+개월)이었다. 신장염으로 인해 이 약을 중단한 환자는 3명(0.1 %)이었다. 5명의 환자는 신장염 증상으로부터 회복하였다.
4) 면역원성
이 약 2 mg/kg을 매 3주마다 투여하거나 200 mg을 매 3주마다 투여하거나 10 mg/kg을 매 2주 또는 3주마다 투여한 임상시험에 참여한 환자 중에서 이 약 치료 중 항약물항체 존재 여부를 평가한 2034명의 환자 중 36명(1.8%)에게서 양성이 보고되었고, 이 중 9명(0.4%)의 환자에서는 펨브롤리주맙에 대한 중화 항체가 양성이었다. 항 ‑펨브롤리주맙 결합 또는 중화 항체 발생에 따라 약동학 또는 안전성 프로파일이 변경된다는 증거는 확인되지 않았다.
5) 재심사에 따른 국내 시판 후 조사결과
국내에서 재심사를 위하여 6년 동안 흑색종, 비소세포폐암, 두경부암, 전형적 호지킨 림프종, 요로상피암, 신세포암(렌바티닙과의 병용요법 제외), 고빈도 ‑현미부수체 불안정성 암(직결장암 포함), 삼중음성유방암, 식도암 환자 1,563명을 대상으로 실시한 시판 후 조사 결과, 이상사례의 발현율은 인과관계와 상관없이 51.06%(798/1,563명, 총 1,774건)로 보고되었다. 이 중 인과관계를 배제할 수 없는 중대한 약물이상반응 및 인과관계를 배제할 수 없는 예상하지 못한 약물이상반응은 발현 빈도에 따라 아래 표에 나열하였다.
|
|
중대한 약물이상반응 16.06% (251/1,563명, 327건) |
예상하지 못한 약물이상반응 14.33% (224/1,563명, 302건) | |
|
드물게(0.1% 미만) |
감염 및 기생충 감염 |
인플루엔자, 비정형 폐렴, 간균 감염, 모세기관지염, 클로스트리듐 디피실레 감염, 위장 감염, 클레브시엘라 감염, 대장 감염, 결핵 수막염. 미코박테리움 아비움 복합체 감염, 식도 칸디다증, 안와 주위 농양, 복막염, 사람 폐포자충 폐렴, 난관염, 요로 감염, 바이러스 감염
|
인플루엔자, 족 백선, 무증상 세균뇨, 간균 감염, 모세기관지염, 칸디다 감염, 간흡충증, 클로스트리듐 디피실레 감염, 위장 감염, 치은염, 단순 포진, 클레브시엘라 감염, 대장 감염, 결핵 수막염, 미코박테리움 아비움 복합체 감염, 고막염, 식도 칸디다증, 중이염, 안와 주위 농양, 복막염, 사람 폐포자충 폐렴, 난관염, 바이러스 혈증 |
|
호흡기, 흉곽 및 종격 장애 |
흉막 삼출, 만성 폐쇄성 폐 질환, 기흉, 천식, 가래 잔류, 상기도 폐쇄 |
만성 폐쇄성 폐 질환, 기흉, 천식, 가래 잔류, 상기도 폐쇄 | |
|
대사 및 영양 장애 |
섭식 저하, 당뇨성 케톤산증, 악액질, 저나트륨 혈증 |
악액질, 통풍 | |
|
각종 위장관 장애 |
복통, 변비, 하복부 통증, 연하 곤란, 위 궤양, 면역-매개 소장 결장염, 장 천공 |
입 건조, 위 궤양, 설통, 면역-매개 소장 결장염, 입술 통증, 식도 통증, 직장염, 혀 부종 | |
|
전신 장애 및 투여 부위 병태 |
사망, 다발성 장기 기능 부전 증후군, 오한, 전신 건강 상태 악화, 자기-관리 장애, 말초 부종, 통증, 종창 |
전신 건강 상태 악화, 오한, 사망, 염발음(비빔 소리), 열감, 자기-관리 장애, 주입 부위 정맥염, 종창, 갈증 | |
|
각종 신경계 장애 |
반신 불완전 마비, 벨 마비, 뇌부종, 뇌혈관 사고, 치매, 어지러움, 두개 내압 증가, 실신 |
반신 불완전 마비, 벨 마비, 뇌부종, 뇌혈관 사고, 치매, 두개 내압 증가, 신경통, 감각 장애, 실신 | |
|
각종 심장 장애 |
심정지, 심인성 쇼크, 심근염, 심장막염 |
방실 차단, 심정지, 심인성 쇼크, 심장막염, 심실 위 빈맥 | |
|
근골격 및 결합 조직 장애 |
근육통 |
옆구리 통증, 근육 쇠약, 회전 근개 증후군, 서혜부 통증, 척추 내 추간판 돌출, 요추 척추관 협착, 근막 통증 증후군, 골다공증, 발바닥 근막염, 척추관 협착 | |
|
간담도 장애 |
담관염, 담낭염, 담석증 |
담관염, 담낭염, 담석증 | |
|
신장 및 요로 장애 |
질소 혈증, 출혈성 방광염, 신장염, 요관 결석증 |
질소 혈증, 출혈성 방광염, 독성 신장 병증, 야간뇨, 요관 결석증 | |
|
혈액 및 림프계 장애 |
중성구 감소증, 혈구 감소증, 혈소판 감소증 |
백혈구증, 혈구 감소증 | |
|
손상, 중독 및 시술 합병증 |
대퇴골경 골절, 척추 압박 골절, 경추 골절 |
대퇴골경 골절, 척추 압박 골절, 경추 골절, 쇄골 골절 | |
|
양성, 악성 및 상세 불명의 신생물(낭종 및 용종 포함) |
급성 골수 단핵구성 백혈병, 유방암, 유두양 갑상선암
|
급성 골수 단핵구성 백혈병, 유방암, 지방종, 유두양 갑상선암, 지루 각화 | |
|
각종 눈 장애 |
백내장, 맥락 망막 병증, 시신경 유두 부종
|
백내장, 시각 장애, 안검염, 맥락 망막 병증, 각막 미란, 눈 장애, 눈 부종, 눈 통증, 시신경 유두 부종, 유리체 부유물 | |
|
피부 및 피하 조직 장애 |
수포성 출혈성 피부병, 피부염, 수포성 피부염, 소양증
|
피부 궤양, 수포성 출혈성 피부병, 손 피부염, 다한증, 색소 침착 장애, 딱지, 피부 병변, 피부 독성 | |
|
각종 정신 장애 |
섬망, 정신 상태 변화
|
섬망, 혼돈 상태, 적응 장애, 눈맞춤 감소, 정신 상태 변화 | |
|
임상 검사 |
혈액 빌리루빈 증가, 혈압 증가
|
혈액 갑상선 자극 호르몬 감소, 혈액 요소 증가, 체액 균형 양성, 림프구 백분율 증가, 산소 포화도 감소 | |
|
각종 혈관 장애 |
심부 정맥 혈전증, 말초 동맥 폐색성 질환 |
심부 정맥 혈전증, 저혈압, 말초 동맥 폐색성 질환, 정맥염 | |
|
귀 및 미로 장애 |
|
귀지떡, 외이 염증, 청각 저하 | |
|
각종 내분비 장애 |
애디슨병, 뇌하수체염, 이차 부신 피질 부전, 갑상선염 |
애디슨병 | |
|
때때로 (0.1~ 5%미만) |
감염 및 기생충 감염 |
폐렴, 흡인성 폐렴, 패혈성 쇼크, 연조직염, 충수염
|
대상 포진, 구강 칸디다증, 기관지염, 치주염, 연조직염, 충수염, 손발톱 진균증, 손발톱 주위염, 바이러스 감염 |
|
호흡기, 흉곽 및 종격 장애 |
간질성 폐 질환, 호흡 곤란, 폐염증, 폐 색전증, 객혈, 급성 호흡 곤란 증후군, 면역-매개 폐 질환, 기질성 폐렴 |
흉막 삼출, 간질성 폐 질환, 콧물, 딸꾹질, 급성 호흡 곤란 증후군, 기질성 폐렴
| |
|
대사 및 영양 장애 |
1형 및 2형 당뇨병, 저칼륨 혈증, 고칼륨 혈증, 식욕 감소 |
섭식 저하, 2형 당뇨병, 이상 지질 혈증 | |
|
각종 위장관 장애 |
설사, 장폐색증, 구토, 오심, 급성 췌장염
|
소화 불량, 위 식도 역류 질환, 위염, 복부 팽창, 장폐색증, 비감염성 타액선염, 구강 통증, 급성 췌장염 | |
|
전신 장애 및 투여 부위 병태 |
무력증, 발열, 피로
|
흉통, 전신 부종, 안면 부종, 통증, 한랭감 | |
|
각종 신경계 장애 |
말초 신경 병증, 뇌경색, 두통 |
지각 이상, 뇌경색 | |
|
각종 심장 장애 |
심방세동, 심장막 삼출 |
심방세동, 심장막 삼출 | |
|
근골격 및 결합 조직 장애 |
사지 통증, 근육염, 횡문근 융해 |
골관절염, 횡문근 융해 | |
|
간담도 장애 |
간염, 급성 담낭염 |
급성 담낭염 | |
|
신장 및 요로 장애 |
급성 신 손상, 신부전 |
배뇨 곤란, 빈뇨, 신부전 | |
|
혈액 및 림프계 장애 |
빈혈 |
| |
|
피부 및 피하 조직 장애 |
|
건성 피부 | |
|
각종 정신 장애 |
|
불안, 우울증, 불안 장애 | |
|
임상 검사 |
|
C-반응 단백질 증가, 백혈구 수 증가, 혈소판 수 감소 | |
|
귀 및 미로 장애 |
|
체위성 현훈 | |
|
각종 내분비 장애 |
갑상선 저하증, 부신 부전, 갑상선 항진증 |
| |
|
생식계 및 유방장애 |
|
양성 전립선 과형성 | |
감염 : 폐렴(pneumonia)
근골격 및 결합조직계 : 횡문근 융해(가로무늬근 융해)
4. 일반적 주의
1) 면역 ‑매개 약물이상반응
이 약 투여 환자에서 중증인 사례와 치명적인 사례를 포함한 면역 ‑매개 약물이상반응이 발생한 바 있다. 면역 ‑매개 약물이상반응은 치료를 중단한 이후에도 발생할 수 있다. 임상 연구들에서는 면역 ‑매개 약물이상반응의 대부분이 가역적이고 이 약 투여 일시 중단, 코르티코스테로이드 투여 및/또는 보조 치료 투여로 관리 가능했다. 하나 이상의 조직에 영향을 미치는 면역 ‑매개 약물이상반응이 동시에 발생할 수 있다.
의심되는 면역 ‑매개 약물이상반응에 대해서는 적절한 평가를 통해 병인을 확인하고 약물이상반응의 중증도를 토대로 이 약 투여를 보류하고 코르티코스테로이드 투여를 고려한다. 1등급 이하로 개선되면 코르티코스테로이드를 최소 1개월 이상의 기간을 두고 점감 절차를 시작해야 한다. 면역 관련 약물이상반응이 코르티코스테로이드 사용으로 조절이 되지 않는 환자의 경우 다른 전신 면역억제제의 투여를 고려할 수 있다. 코르티코스테로이드 점감 절차를 실시한 이후에 약물이상반응이 1등급 이하에 머무르면 이 약 투여를 재개한다. 중증 약물이상반응 사례가 다시 발생하면, 이 약 투여를 영구 중단한다. (용법용량 및 3. 이상사례, 1) 임상시험에서 보고된 이상사례 항 참고)
⓵ 면역 ‑매개 폐염증
이 약 투여 환자에서 치명적인 사례를 포함한 폐염증이 보고되었다. 폐염증의 징후와 증상에 대해 환자를 모니터링해야 한다. 폐염증이 의심되면 방사선영상 검사를 실시한다. 중등증(2등급) 이상의 폐염증의 경우 코르티코스테로이드를 투여(프레드니손으로 초회 용량 1 ‑2 mg/kg/day 또는 이에 상응하는 양을 투여하고 이후 점감)한다. 중등증(2등급) 폐염증의 경우 이 약 투여를 보류하며, 중증(3등급), 생명을 위협하는(4등급) 폐염증 또는 재발성 중등증(2등급) 폐염증의 경우에는 이 약 투여를 영구 중단한다.
⓶ 면역 ‑매개 결장염
이 약 투여 환자에서 결장염이 보고되었다. 결장염의 징후와 증상에 대해 환자를 모니터링해야 한다. 중등증(2등급) 이상의 결장염의 경우 코르티코스테로이드를 투여(프레드니손으로 초회 용량 1 ‑2 mg/kg/day 또는 이에 상응하는 양을 투여하고 이후 점감)한다. 중등증(2등급) 또는 중증(3등급)의 결장염의 경우 이 약 투여를 보류하며, 생명을 위협하는(4등급) 결장염의 경우 이 약 투여를 영구 중단한다.
⓷ 면역 ‑매개 간염 (이 약) 및 간독성 (이 약과 엑시티닙 병용 요법)
면역 ‑매개 간염
이 약 투여 환자에서 간염이 보고되었다. 간 기능의 변화(치료 시작 시점, 치료 기간 중에는 정기적으로 실시 및 임상 평가를 토대로 필요한 경우 실시)와 간염의 증상에 대해 환자를 모니터링해야 한다. 코르티코스테로이드를 투여(프레드니손으로 초회 용량을 2등급 간염의 경우 0.5 ‑1 mg/kg/day, 3등급 이상의 간염의 경우 1 ‑2 mg/kg/day 또는 이에 상응하는 양을 투여하고 이후 점감)하고 간 효소 상승의 중증도에 따라 이 약 투여를 보류 또는 중단한다.
엑시티닙과의 병용 시 간독성
이 약의 단독투여 시와 비교하여 이 약과 엑시티닙의 병용 투여 시에는 예상되었던 발생률보다 높은 빈도의 3등급 및 4등급의 ALT 및 AST 상승과 같은 간독성이 발생할 수 있다. 치료를 시작하기 전과 치료하는 동안 정기적으로 간 효소를 모니터링해야 한다. 단독요법으로 사용될 때에 비해 간 효소를 더 자주 모니터링할 것을 고려한다. 간 효소 상승 시 이 약 및 엑시티닙의 투여를 일시 중단하고, 필요 시 코르티코스테로이드의 투여를 고려한다 (용법용량 참고).
이 약과 엑시티닙의 병용 투여 시 3등급 및 4등급의 ALT 증가(20%) 및 AST 증가(13%)가 보고되었다. ALT 증가가 발병하는 시간의 중앙값은 2.3개월(범위: 7일 ~ 19.8개월) 이었다. ALT 증가인 환자들 중 59%는 전신 코르티코스테로이드를 투여받았다. ALT가 정상 상한치의 3배 이상인 환자들(2~4등급, n=116) 중 94%에서 ALT가 0~1등급으로 회복되었다. 이 약(3%) 또는 엑시티닙(31%) 단독요법, 또는 두 약의 병용요법(50%)으로 재투여한 92명의 환자들 중 55%는 ALT가 정상 상한치의 3배 초과로 상승하는 재발을 보이지 않았다.
⓸ 면역 ‑매개 신장염
이 약 투여 환자에서 신장염이 보고되었다. 신기능의 변화에 대해 환자를 모니터링한다. 중등증(2등급) 이상의 신장염의 경우 코르티코스테로이드를 투여(프레드니손으로 초회 용량 1 ‑2 mg/kg/day 또는 이에 상응하는 양을 투여하고 이후 점감)한다. 중등증(2등급) 신장염의 경우 이 약 투여를 보류하며, 중증(3등급) 내지 생명을 위협하는(4등급) 신장염의 경우 이 약 투여를 영구 중단한다.
⓹ 면역 ‑매개 내분비병증
이 약 투여 환자에서 부신 부전(원발성 및 속발성)이 보고되었다.
이 약 투여 환자에서 뇌하수체염도 보고되었다. 부신 부전 및 뇌하수체염 (뇌하수체기능저하증 포함)의 징후와 증상에 대해 환자를 모니터링한다. 코르티코스테로이드를 투여하고 임상적으로 필요한 경우 다른 호르몬 대체요법을 실시한다. 중등증(2등급) 부신 부전 또는 뇌하수체염의 경우 이 약 투여를 보류하며, 중증(3등급) 내지 생명을 위협하는(4등급) 부신 부전 또는 뇌하수체염의 경우 이 약 투여를 보류 또는 중단한다.
이 약 투여 환자에서 당뇨병성 케토산증을 포함하는 제1형 당뇨병이 보고되었다. 고혈당증 또는 다른 당뇨병의 징후와 증상에 대해 환자를 모니터링해야 한다. 제1형 당뇨병의 경우 인슐린을 투여하고 중증의 고혈당증의 경우 대사조절에 도달할 때까지 이 약 투여를 보류한다.
이 약 투여 환자에서 갑상선기능항진증, 갑상선 저하증 및 갑상선염을 포함하는 갑상선 장애가 보고되었으며 치료 중 언제라도 발생할 수 있다. 그러므로 갑상선 기능의 변화(치료 시작 시점, 치료 기간 중에는 정기적으로 모니터링 및 임상 평가를 토대로 필요한 경우 모니터링)와 갑상선 장애의 임상적 징후와 증상에 대해 모니터링해야 한다. 갑상선 저하증의 경우 호르몬 대체요법을 실시한다. 갑상선기능항진증은 티오나마이드 및 베타 차단제로 적절히 관리한다. 중증(3등급) 또는 생명을 위협하는(4등급) 갑상선기능항진증의 경우 투여를 일시 또는 영구 중단한다.
➅ 중증의 피부반응
이 약 투여 환자에서 면역 ‑매개의 중증의 피부반응이 보고되었다. 중증의 피부반응이 의심되면 환자를 모니터링하고 다른 원인들을 배제한다. 약물이상반응의 중증도에 따라 이 약 투여를 보류 또는 영구 중단하고 코르티코스테로이드를 투여한다(용법용량 참고).
이 약 투여 환자에서 스티븐스 ‑존슨 증후군(SJS)과 독성표피괴사융해증(TEN)이 보고되었으며, 일부는 치명적인 경과를 보였다. 스티븐스 ‑존슨 증후군 또는 독성표피괴사융해증의 징후 또는 증상이 있으면, 이 약 투여를 보류하고 보다 전문적인 평가와 치료를 위한 기관에 위탁한다. 만약 스티븐스 ‑존슨 증후군 또는 독성표피괴사융해증이 확진되면, 이 약 투여를 영구 중단한다(용법용량 참고).
⑦ 기타 면역 ‑매개 약물이상반응
이 약을 투여받은 환자 2799명 중 1% 미만(별도의 표시가 없는 경우)에서 다음의 임상적으로 중요한 면역관련 약물이상반응이 확인되었다: 관절염(1.5%), 포도막염, 근염, 길랑 ‑바레증후군, 중증근무력증(악화 포함), 혈관염, 췌장염, 용혈성 빈혈, 사르코이드증, 뇌염, 척수염, 부갑상선 저하증, 위염. 다음은 이 약의 다른 임상시험 또는 시판 후 사용에서 보고되었다: 심근염, 경화성 담관염, 췌장 외분비선 기능 부전.
면역 ‑매개 약물이상반응 중 일부는 중증이었으며 임상시험 중 또는 시판 후 사용에서 보고되었다.
⑧ 이식 관련 약물이상반응
시판 후 사용에서 이 약을 투여받은 환자에서 고형 장기 이식 거부가 보고되었다. 이 약은 고형 장기 이식 거부의 위험성을 증가시킬 수 있다. 이러한 환자에게 투여할 경우, 이 약 투여에 따른 유익성 대비 이식 거부 가능성에 따른 위험성을 고려해야 한다.
이 약을 투여받은 동종이형 조혈모세포이식수술(HSCT) 이력이 있는 환자에서 치명적인 이식편대숙주질환(GVHD)을 포함한 급성 이식편대숙주질환이 보고되었다. 이식 수술 후 이식편대숙주질환을 경험한 환자들은 이 약 투여 이후 이식편대숙주질환의 위험이 증가할 수 있다. 동종이형 조혈모세포이식수술 이력이 있는 환자에서는 이 약 투여에 따른 유익성 대비 이식편대숙주질환의 위험성을 고려해야 한다.
2) 다발성 골수종 환자에게 이 약을 탈리도마이드 유사체와 덱사메타손 병용 요법에 추가 시 사망률 증가
다발성 골수종 환자에 대한 무작위배정 임상시험 2건에서 이 약을 탈리도마이드 유사체와 덱사메타손 병용 요법에 추가했을 때 사망률이 증가하였고, 이러한 병용요법에 대해 이 약의 사용이 허가되어 있지 않다. 다발성 골수종 환자에게 탈리도마이드 유사체와 덱사메타손 병용요법에 이 약을 추가하는 요법은 적절하지 않다.
3) 주입 관련 반응
KEYNOTE ‑001, 002, 006, 010에서 이 약을 투여 받은 2799명의 환자 중 6명(0.2%)에서 과민증과 아나필락시스를 포함하는 중증의 주입 관련 반응이 보고되었다. 중증 또는 생명을 위협하는 주입 관련 반응의 경우, 주입을 멈추고 이 약의 투여를 영구 중단한다(용법용량 참고). 경증 또는 중등증의 주입 관련 반응의 경우, 면밀히 모니터링 하며 이 약의 투여를 계속할 수 있다; 해열제와 항히스타민제로 전치료하는 것을 고려할 수 있다.
5. 상호작용
이 약에 대해 공식적인 약동학적 약물 상호작용 연구는 수행된 바 없다. 펨브롤리주맙은 혈액에서 이화작용을 통해 소실되므로 대사적 약물 ‑약물 상호작용은 예상되지 않는다.
이 약의 약력학적 활성 및 유효성이 저해될 가능성이 있으므로 이 약 투여를 시작하기 전에 전신 코르티코스테로이드 또는 면역억제제의 사용을 피해야 한다. 하지만 이 약 투여를 시작한 이후에 면역 ‑매개 약물이상반응의 치료를 위해서는 전신 코르티코스테로이드 또는 면역억제제를 사용할 수 있다. 이 약을 화학요법제와 병용하여 투여할 때, 예방적 항구토제 및/또는 화학요법제와 관련된 약물이상반응 완화의 목적으로 코르티코스테로이드를 전치료로 사용할 수 있다.
6. 임부, 수유부, 가임여성에 대한 투여
1) 임부 및 가임여성: 이 약의 임신 중 투여에 관한 안전성은 확립되어 있지 않으므로 임부 또는 임신하고 있을 가능성이 있는 여성에게는 투여하지 않는다. 임부에 대한 이 약의 사용에 관한 자료는 없다. 이 약에 대한 비임상 생식독성시험은 수행되지 않았지만 설치류 임신 모델 연구에서는 PD ‑L1 신호전달을 차단하면 태아의 내성이 저해되어 태아 소실이 증가하는 것으로 증명되었다. 이는 작용기전에 의하여 임신 중 이 약 투여 시 태아 소실 또는 사산의 발생률 증가를 포함하여 태아 손상의 위험 가능성이 있음을 시사한다. 인간 IgG4는 태반 장벽을 통과하는 것으로 알려져 있으며 이 약은 IgG4의 일종이므로 산모로부터 태아에게 이행될 가능성이 있다. 가임 여성은 이 약 치료 중 및 이 약 최종 투여 후 최소 4개월 동안 효과적인 피임법을 사용해야 한다.
2) 수유부: 이 약이 사람 모유로 분비되는지 여부는 알려지지 않았다. 인간 IgG는 모유 중으로 이행되므로 수유부에게 투여하는 경우에는 수유를 중단하도록 한다.
7. 소아 등에 대한 투여
KEYNOTE ‑051에서 진행성 흑색종, 림프종, PD ‑L1 양성 또는 MSI ‑H인 진행성, 재발성 또는 불응성 고형암을 지닌 소아 환자 161명(6개월부터 12세 미만 어린이 62명, 12세부터 17세 청소년 99명)에게 이 약 2 mg/kg를 매 3주마다 투여하였다. 이 중 재발성 또는 불응성인 전형적 호지킨 림프종 소아 환자는 22명(11 ‑17세)이었다. 이 약을 투여받은 환자의 투여 횟수 중앙값은 4회(범위: 1 ‑35회)였고, 138명(86%)의 환자들은 이 약을 2회 이상 투여받았다. 매 3주마다 2 mg/kg로 투여한 소아 환자에서의 이 약의 혈중 농도는 동일 요법으로 투여한 성인 환자에서와 유사하였다.
소아 환자에서 이 약의 안전성 프로파일은 성인에서와 유사하였다. 가장 빈번한 약물이상반응(적어도 20%의 소아 환자에서 보고됨)은 발열, 구토, 두통, 복통, 빈혈, 기침 그리고 변비였다.
8. 고령자에 대한 투여
전반적으로 고령자(65세 이상)와 65세 미만 성인 간에 안전성 또는 유효성의 차이는 보고되지 않았다. 이 환자군에서 용량 조절은 필요하지 않다.
9. 신장애 환자에 대한 투여
경증 또는 중등증 신장애 환자에게는 용량 조절이 필요하지 않다. 중증 신장애 환자를 대상으로 한 이 약에 대한 연구는 수행된 바 없다.
10. 간장애 환자에 대한 투여
경증 또는 중등증 간장애 환자에게는 용량 조절이 필요하지 않다. 중증 간장애 환자를 대상으로 한 이 약에 대한 연구는 수행된 바 없다.
11. 과량투여 시의 처치
이 약 과량투여에 대한 정보는 없다. 과량투여 시, 약물이상반응의 징후나 증상에 대해 면밀히 모니터링하고, 적절한 대증치료를 실시해야 한다.
12. 적용상의 주의
1) 조제 및 투여방법
‑ 차광보관한다. 얼리지 않는다. 제품을 흔들지 않는다.
‑ 이 약 바이알을 실온에 도달하게 한다.
‑ 이 약 바이알은 희석하기 전 최대 24시간까지 냉장고 밖(25℃ 이하)에서 보관할 수 있다.
‑ 투여 전에 이 약 바이알을 육안으로 검사하여 이물과 변색 여부를 확인한다. 이 약은 투명하거나 약간 유백광의 무색 또는 옅은 노란색의 액체이다. 육안 확인 시 이물이 확인되면 바이알을 폐기한다.
‑ 투여 용량을 최대 4 mL(100 mg)까지 취한 후 이를 0.9% 생리식염주사액 또는 5% 포도당(덱스트로스)을 함유한 정맥수액백에 옮겨 최종 농도 1 ‑10 mg/mL로 희석한다. 희석한 용량을 천천히 위아래로 뒤집어서 잘 섞는다. (흔들지 말 것)
‑ 점적 주입액(희석된 용액)을 얼리지 않는다.
‑ 이 약은 보존제가 함유되지 않았다. 희석된 의약품은 즉시 사용해야 한다. 즉시 사용하지 않는 경우 희석된 용액은 실온에서 총 6시간까지 보관할 수 있다. 희석된 용액은 2 ‑8℃에서 냉장 보관할 수 있지만 희석부터 점적주입 완료까지 총 소요시간이 96시간을 초과해서는 안 된다. 냉장 보관한 경우에는 바이알 및/또는 정맥수액백을 꺼내두어 실온에 도달한 뒤 사용해야 한다.
‑ 희석된 용액을 30분에 걸쳐서 0.2 ‑5 μm 크기의 멸균, 비발열성, 저단백결합 내장 또는 외장 필터를 사용하여 정맥으로 점적 주입한다.
‑ 같은 점적주입 라인으로 다른 약물을 함께 투여하지 않는다.
‑ 사용하지 않고 남은 바이알 내용물은 폐기한다.
13. 임상약리학
1) 약리작용 정보
이 약(펨브롤리주맙)은 단일클론항체 항악성종양제이다.
이 약은 PD ‑1에 대한 높은 결합 친화성을 지닌 항체로, 항원제시세포 또는 종양세포에서 PD ‑1 경로에 관여하는 PD ‑L1 및 PD ‑L2를 포함한 리간드의 이중 리간드 억제(dual ligand blockade) 작용을 한다. 이 약은 PD ‑1 수용체와 그 리간드의 결합을 방해함으로써, 종양 미세환경에서 종양 ‑특이적 세포독성 T 림프구 및 항종양 면역반응을 재활성화한다.
이 약 2 mg/kg을 매 3주마다 투여하거나 10 mg/kg을 매 2주 또는 3주마다 투여한 환자의 말초혈액에서, 순환하는 T ‑림프구 수의 증가 없이 활성화된(즉, HLA ‑DR+) CD4+ 및 CD8+ T ‑세포의 비율이 증가한 것으로 관찰되었다.
비임상 설치류 모델 연구에서, 항마우스 PD ‑1 항체와 티로신 키나제 억제제 (tyrosine kinase inhibitor, TKI)의 조합은 두 약제 단독에 비해 향상된 항종양 활성을 입증했다.
2) 약동학적 정보
이 약의 약동학은 이 약을 매 2주마다 1~10 mg/kg을 투여하거나 매 3주마다 2~10 mg/kg 또는 200 mg를 투여한 2993명의 다양한 암환자들을 대상으로 연구되었다. 이 약의 약동학에 있어 적응증 간 임상적으로 의미있는 차이는 없었다.
흡수
이 약은 정맥으로 투여되기 때문에 즉시 그리고 완전히 생체이용가능하다.
분포
제한적인 혈관 외 분포와 상응하게, 이 약의 정상 상태(steady state)에서의 분포 용적은 작다(6.0 L; 변동 계수[CV]: 20%). 항체 제제에서 기대되는 바와 같이, 이 약은 혈장 단백질과 특이적 결합을 하지 않는다.
대사
이 약은 비특이적 경로로 이화된다; 대사는 이 약의 클리어런스에 기여하지 않는다.
제거
이 약의 클리어런스(CV%)는 첫 투여 시(252 mL/day [CV%: 37%])에 비해 정상 상태에서 최대 변화를 달성한 후 약 23% 낮다[기하학적 평균, 195 mL/day(40%)]; 이러한 시간에 따른 클리어런스의 감소는 임상적으로 유의미하지 않다고 여겨진다. 소실기 반감기(t<SUB>1/2</SUB>)의 기하학적 평균값(CV%)은 22일(32%)이다.
이 약은 매 3주마다 반복 투여 시 16주차에 정상 상태 농도에 도달하였으며 전신 축적은 2.1배였다. 이 약의 최고 농도(C<SUB>max</SUB>), 최저 농도(C<SUB>min</SUB>) 및 정상 상태에서 시간 ‑혈장농도 곡선 하 면적(AUC<SUB>ss</SUB>)은 매 3주마다 투여 시 2~10 mg/kg 범위에서 용량 비례적으로 증가하였다.
특수 환자 집단
이 약의 약동학에 대한 다양한 공변량(covariates)의 영향은 집단 약동학 분석에서 평가되었다. 연령(15 ‑94세 범위), 성별, 인종, 경증 또는 중등증 신기능 장애, 경증 또는 중등증 간장애 및 종양 부담과 같은 인자들은 이 약의 클리어런스에 임상적으로 유의한 영향을 미치지 않았다. 매 3주마다 2 mg/kg 체중 기반 용량으로 투여한 소아 환자(2 ‑17세)에서의 혈중 농도는 동일 용량으로 투여한 성인 환자에서와 유사하다.
신장애 환자
신 기능 장애가 이 약의 클리어런스에 미치는 영향은 경증(GFR 60 이상 90 미만 mL/min/1.73 m<SUP>2</SUP>) 또는 중등증(GFR 30 이상 60 미만 mL/min/1.73 m<SUP>2</SUP>) 신장애 환자와 정상(GFR 90 이상 mL/min/1.73 m<SUP>2</SUP>) 신기능 환자를 비교한 집단 약동학 분석에서 평가되었다. 경증 또는 중등증 신장애 환자와 정상 신기능 환자 사이에서 이 약의 클리어런스에 임상적으로 유의한 차이는 관찰되지 않았다. 중증(GFR 15 이상 30 미만 mL/min/1.73 m<SUP>2</SUP>) 신장애 환자를 대상으로 한 이 약에 대한 연구는 수행된 바 없다(9. 신장애 환자에 대한 투여 참고).
간장애 환자
간장애가 이 약의 클리어런스에 미치는 영향은 경증 또는 중등증 간장애[총 빌리루빈(Total bilirubin, TB) 1.0~1.5 x ULN(Upper limit of normal) 또는 AST >ULN 및 AST와 상관 없이 TB > 1.5~3 x ULN, 간기능 장애에 대한 국립암연구소(National Cancer Institute) 기준에 의함] 환자와 정상 간기능(TB 및 AST ≦ULN) 환자를 비교한 집단 약동학 분석에서 평가되었다. 경증 또는 중등증 간장애 환자와 정상 간기능 환자 사이에서 이 약의 클리어런스에 임상적으로 유의한 차이는 관찰되지 않았다. 중증(TB >3 x ULN 및 any AST) 간장애 환자를 대상으로 한 이 약에 대한 연구는 수행된 바 없다(10. 간장애 환자에 대한 투여 참고).
14. 임상시험 정보
흑색종 (Melanoma)
KEYNOTE ‑006: 이필리무맙 치료 경험이 없는 환자를 대상으로 한 대조 임상시험
이 약의 유효성은 이필리무맙 치료 경험이 없으며, 이전에 전신 치료를 한 가지 이상 사용하지 않은 수술이 불가능하거나 전이성인 흑색종 환자 치료 목적의 다기관, 대조 임상 3상 시험인 KEYNOTE ‑006에서 평가되었다. 환자들은 이 약 10 mg/kg을 2주마다(n=279) 또는 3주마다(n=277) 투여받거나 이필리무맙을 투여(n=278) 받도록 무작위 배정(1:1:1) 되었다. 치료 차수(line of therapy), ECOG PS, 및 PD ‑L1 발현 상태에 따라 층화되었다. 자가면역질환 환자 또는 면역억제제를 투여 받는 환자, 이전에 다른 단클론 항체에 중증의 과민증을 보인 환자 및 HIV, B형 간염 또는 C형 간염 환자는 이 임상시험에서 제외되었다. BRAF V600E 돌연변이 양성 흑색종을 앓고 있는 환자에 대해서는 이전에 BRAF 억제제 치료를 받는 것이 필수 요건은 아니었다.
환자들은 질병의 진행 또는 허용 불가능한 독성 발생 전까지 이 약을 투여 받았다. 질병 진행의 초기 증상을 보였으나 임상적으로 안정된 환자들은 질병 진행이 확인될 때까지 치료를 유지하도록 허용되었다. 종양 상태 평가는 12주에 진행되었으며, 그 후 48주까지 6주마다, 그 후에는 12주마다 수행되었다.
KEYNOTE ‑006에 참가한 834명의 환자들 중에서 60%는 남성, 44%는 65세 이상(연령 중앙값 62세[범위 18 ‑89])이었으며 98%는 백인이었다. 66%는 이전에 전신 치료를 받은 경험이 없었으며, 34%는 이전에 1회의 치료 경험이 있었다. ECOG PS는 0(69%) 및 1(31%)이었다. 환자의 80%는 PD ‑L1 양성(22C3 항 PD ‑L1 항체를 사용한 면역 조직 화학 분석에 의해 사전 평가된 종양 및 관련 면역 세포의 1% 이상에서 PD ‑L1 막 발현)이었으며 18%는 PD ‑L1 음성이었다. 65%는 M1c 단계였고, 32%는 상승된 LDH 결과를 보였고 9%는 뇌 전이가 확인되었다. 302명(36%)의 환자에서 BRAF 돌연변이 양성이었다. BRAF 돌연변이 양성인 환자 중 139명(46%)은 이전에 BRAF 억제제로 치료를 진행한 경험이 있었다. 베이스라인 특성은 치료군 전반에 걸쳐 균형을 이루었다.
1차 유효성 평가지표는 전체생존(OS)과 무진행생존(PFS, 고형암 반응평가 기준 RECIST 1.1에 따른 IRO 검토에 의해 평가)이었다. 2차 유효성 평가지표는 객관적 반응률(ORR)과 반응지속기간(DoR)이었다. 주요 유효성 결과는 표 36에 요약되어 있다.
표 36. 이필리무맙 치료 경험이 없는 진행성 흑색종 환자에 대한 2주 또는 3주마다 이 약 10 mg/kg 투여 후 반응 결과 (KEYNOTE ‑006)
|
평가 지표 |
3주마다 이 약 10 mg/kg n=277 |
2주마다 이 약 10 mg/kg n=279 |
이필리무맙 n=278 |
|
전체생존(OS)* |
|
|
|
|
사건 발생 환자 수 (%) |
119 (43%) |
122 (44%) |
142 (51%) |
|
중앙값(개월) (95% CI) |
도달하지 않음 (24, NA) |
도달하지 않음 (22, NA) |
16 (14, 22) |
|
위험비(HR)†(95% CI) |
0.68 (0.53, 0.86) |
0.68 (0.53, 0.87) |
- |
|
p-값‡ |
<0.001 |
<0.001 |
- |
|
IRO§에 의한 무진행생존(PFS)* |
|
|
|
|
사건 발생 환자 수 (%) |
183 (66%) |
181 (65%) |
202 (73%) |
|
중앙값(개월) (95% CI) |
4.1 (2.9, 7.2) |
5.6 (3.4, 8.2) |
2.8 (2.8, 2.9) |
|
위험비(HR)†(95% CI) |
0.61 (0.50, 0.75) |
0.61 (0.50, 0.75) |
- |
|
p-값‡ |
<0.001 |
<0.001 |
- |
|
IRO§에 의한 최상의 객관적 반응¶ |
|
|
|
|
객관적 반응률(ORR) % (95% CI) |
33% (27, 39) |
34% (28, 40) |
12% (8, 16) |
|
IRO§에 의한 반응지속기간(DoR)# |
|
|
|
|
중앙값(개월) (범위) |
도달하지 않음(2.0+, 22.8+) |
도달하지 않음(1.8+, 22.8) |
도달하지 않음(1.1+, 23.8+) |
<SUP>†</SUP>층화된 Cox 비례 위험 모형에 기초한 위험비(HR)(이필리무맙 대비 이 약)
<SUP>‡</SUP>층화된 로그 순위 테스트(log ‑rank test)에 기초함
<SUP>§</SUP>IRO = RECIST 1.1에 따른 독립적인 방사선학 및 종양학자 리뷰
<SUP>¶</SUP>1차 중간 분석에 기초함
<SUP>#</SUP>최종 분석에서 확인된 완전반응(CR) 또는 부분반응(PR)을 보인 최상의 객관적 반응 환자를 기준으로 함
NA = 가용하지 않음
이 연구는 이 약 10mg/kg을 2주 및 3주마다 투여시 이필리무맙 대비 OS 및 PFS에 대한 통계적으로 유의미한 개선을 입증하였다.
그림 1. KEYNOTE ‑006 치료군의 전체생존(OS) Kaplan ‑Meier 곡선 (ITT 집단)
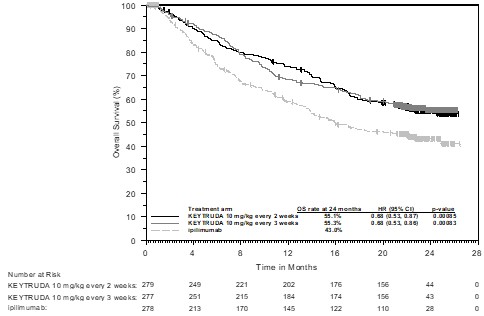
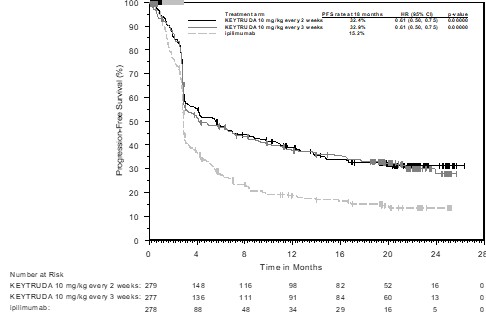
이 약의 유효성은 이전에 이필리무맙 치료 경험이 있고 BRAF V600 돌연변이 양성의 경우 BRAF 또는 MEK 억제제 치료를 받은 수술 불가능하거나 전이성 흑색종 환자 대상의 다기관, 대조 임상시험인 KEYNOTE ‑002에서 평가되었다. 환자들은 이 약 3주마다 2 mg/kg(n=180)군, 또는 10 mg/kg(n=181)군 또는 화학요법(n=179; 다카바진, 테모졸로미드, 카보플라틴, 파클리탁셀, 또는 카보플라틴+파클리탁셀 포함)에 무작위 배정(1:1:1) 되었다. 자가면역질환 환자 또는 면역억제제를 투여 받는 환자, 이필리무맙 치료에서 중증 또는 생명을 위협하는 면역 ‑매개 이상반응의 병력을 가진 환자, 12주 이상의 코르티코스테로이드 치료(10 mg/day 이상의 프레드니손 또는 이와 동등)를 필요로 하는 3 또는 4등급의 독성을 경험한 환자, 이전에 다른 단클론 항체에 중증의 과민증을 보인 환자, 폐염증 및 간질성 폐 질환 병력이 있는 환자, HIV, B형 간염 또는 C형 간염 환자는 이 임상시험에서 제외되었다.
환자들은 질병의 진행 또는 허용 불가능한 독성 발생 전까지 이 약을 투여하였다. 질병 진행의 초기 증상을 보였으나 임상적으로 안정된 환자들은 질병 진행이 확인될 때까지 치료를 유지하도록 허용되었다. 종양 상태 평가는 12주에 진행되었으며, 그 후 6주마다 48주까지, 그 후에는 12주마다 수행되었다. 최초 계획된 질병 평가 후 독립적 평가시 질병이 진행된 화학요법군의 환자는 이중 맹검 방식으로 3 주마다 2 mg/kg 또는 10 mg/kg의 이 약을 투여 받을 수 있었다.
KEYNOTE ‑002에 참가한 540명의 환자들 중에서 61%는 남성, 43%는 65세 이상(연령 중앙값 62세[범위 18 ‑89])이었으며 98%는 백인이었다. 82%는 M1c 단계의 환자이며, 73%는 두 가지 그리고 32%는 세 가지 이상의 진행성 흑색종에 대한 전신 치료 경험을 가지고 있었다. ECOG PS 1(45%)이었으며, 40%는 상승된 LDH 결과를 보였고 23%는 BRAF 돌연변이 유전자를 가지고 있었다. 베이스라인 특성은 치료군 전반에 걸쳐 균형이 잘 잡혔다.
1차 유효성 평가지표는 무진행생존(PFS, RECIST 1.1에 따른 IRO 검토에 의해 평가) 및 전체생존(OS)이었다. 2차 유효성 평가지표는 무진행생존(PFS, RECIST 1.1에 따른 연구자평가), 객관적 반응률(ORR) 및 반응지속기간(DoR)이었다. 이전에 이필리무맙 치료를 받은 환자의 주요 유효성 결과는 표 37에 요약되어 있다.
표 37. 수술 불가능하거나 전이성 흑색종 환자에 대한 이 약 2 mg/kg 또는 10 mg/kg 3주마다 투여 후 유효성 결과 (KEYNOTE ‑002)
|
평가 지표 |
3주마다 이 약 2 mg/kg n=180 |
3주마다 이 약 10 mg/kg n=181 |
화학요법 n=179 |
|
전체생존(OS)* |
|
|
|
|
사건 발생 환자 수 (%) |
123 (68%) |
117 (65%) |
128 (72%) |
|
중앙값(개월) (95% CI) |
13.4 (11.0, 16.4) |
14.7 (11.3, 19.5) |
11.0 (8.9, 13.8) |
|
위험비(HR)†(95% CI) |
0.86 (0.67, 1.10) |
0.74 (0.57, 0.96) |
- |
|
p-값‡ |
0.117 |
0.011ß |
- |
|
IRO§에 의한 무진행생존(PFS)* |
|
|
|
|
사건 발생 환자 수 (%) |
150 (83%) |
144 (80%) |
172 (96%) |
|
중앙값(개월) (95% CI) |
2.9 (2.8, 3.8) |
3.0 (2.8, 5.2) |
2.8 (2.6, 2.8) |
|
위험비(HR)†(95% CI) |
0.58 (0.46, 0.73) |
0.47 (0.37, 0.60) |
- |
|
p-값‡ |
<0.001 |
<0.01 |
- |
|
IRO§에 의한 최상의 객관적 반응¶ |
|
|
|
|
객관적 반응률(ORR) % (95% CI) |
21% (15, 28) |
25% (19, 32) |
4% (2, 9) |
|
IRO§에 의한 반응지속기간(DoR)# |
|
|
|
|
중앙값(개월) (범위) |
22.8 (1.4+, 25.3+) |
도달하지 않음(1.1+, 28.3+) |
6.8 (2.8, 11.3) |
<SUP>†</SUP>층화된 Cox 비례 위험 모형에 기초한 위험비(HR)(화학요법 대비 이 약)
<SUP>‡</SUP>층화된 로그 순위 테스트(log ‑rank test)에 기초함
<SUP>§</SUP>IRO = RECIST 1.1에 따른 독립적 방사선학 및 종양학자 리뷰
<SUP>¶</SUP>2차 중간 분석에 기초함
<SUP>#</SUP>최종 분석에서 확인된 완전반응(CR) 또는 부분반응(PR)을 보인 최상의 객관적 반응 환자를 기준으로 함
<SUP>ß</SUP>다중성 조정 후 통계적으로 유의하지 않음
이 연구는 이 약 2 mg/kg 및 10 mg/kg을 3주마다 투여시 화학요법 대비 PFS에 대한 통계적으로 유의한 개선을 입증하였다.
그림 3. KEYNOTE ‑002 치료군의 무진행생존 (PFS)에 대한 Kaplan ‑Meier 곡선 (ITT 집단)
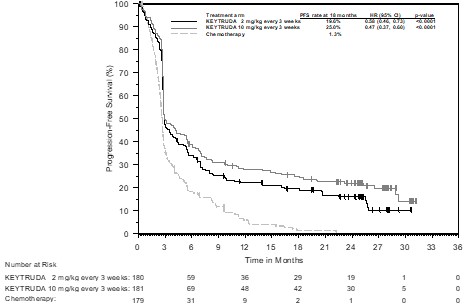
KEYNOTE ‑716: 완전 절제술을 받은 IIB 또는 IIC기 흑색종 환자의 보조요법 치료에 대한 위약 대조 임상시험
이 약의 유효성은 완전히 절제된 stage IIB 또는 IIC기 흑색종 환자를 대상으로 한 다기관, 무작위 이중 맹검 위약 대조 연구인 KEYNOTE ‑716에서 평가되었다. 총 976명의 환자가 질병이 재발하거나 허용 불가능한 독성 발생 전까지 최대 1년까지 이 약을 200 mg [12세 이상 18세 미만의 경우, 2 mg/kg (최대 200 mg)] 3주마다 정맥 투여(n=487) 또는 위약을 투여(n=489) 하도록 무작위 배정(1:1) 되었다. 무작위 배정은 T 병기(AJCC 8판 기준)에 의해 층화되었다. 환자는 연구 시작 전에 흑색종에 대한 완전한 외과적 절제를 넘어서는 흑색종 치료를 받은 적이 없어야 한다. 활성 자가면역질환이 있거나 면역억제를 필요로 하거나 점막 또는 안구 흑색종을 가진 환자들은 제외되었다.
976명의 시험 참가자의 베이스라인 특성은 다음과 같았다: 연령 중앙값(median age) 61세 (범위: 16 ‑87세), 65세 이상 39%, 남성 60%, ECOG PS 0(93%) 및 ECOG PS 1(7%)이었다. 64%는 IIB기, 35%는 IIC기 였다.
1차 유효성 평가지표는 전체 집단에서 임상 시험 연구자가 평가한 무재발 생존(RFS)이다. 2차 평가지표는 전체 집단에서 무원격전이 생존(DMFS)과 전체 생존(OS)이다. 현재까지의 중간 분석에서 OS는 공식적으로 평가되지 않았다.
* RFS: 무작위 배정한 날짜에서 첫 번째 재발 날짜(국소, 주위 또는 원격전이) 또는 사망 중 먼저 발생한 날까지의 기간
이 연구는 초기에 이 약 200mg을 3주마다 투여시 위약 대비 RFS 및 DMFS에 대한 통계적으로 유의미한 개선을 입증했다. 사전 지정된 RFS와 DMFS 중간 분석에서 보고된 결과는 각각 표 38, 그리고 표 38 및 그림 5에 요약되어 있으며, 추적 관찰 기간 중앙값은 각각 14.3개월, 그리고 26.9개월이었다.
표 38. 유효성 결과 (KEYNOTE ‑716)
|
평가지표 |
3주마다 이 약 200 mg n=487 |
위약 n=489 |
|
무재발 생존(RFS) | ||
|
사건 발생 환자의 수 (%) |
54 (11%) |
82 (17%) |
|
18개월 시점의 무재발 생존(RFS) 비율 |
85.8% |
77% |
|
중앙값 (개월) (95% CI) |
NR (22.6, NR) |
NR (NR, NR) |
|
위험비(HR)* (95% CI) |
0.65 (0.46, 0.92) | |
|
p-값 (층화 된 로그 순위) |
0.00658 | |
| 무원격전이 생존(DMFS) | ||
| 사건 발생 환자의 수 (%) | 63 (13%) | 95 (19%) |
|
24개월 시점의 무원격전이 생존(DMFS) 비율 |
88.1% |
82.2% |
| 중앙값 (개월) (95% CI) |
NR (NR, NR) |
NR (NR, NR) |
|
위험비(HR)* (95% CI) |
0.64 (0.47, 0.88) | |
|
p-값 (층화 된 로그 순위) |
0.00292 | |
NR = 도달하지 않음
그림 4. KEYNOTE ‑716의 무재발 생존(RFS) Kaplan ‑Meier 곡선 (ITT 집단)
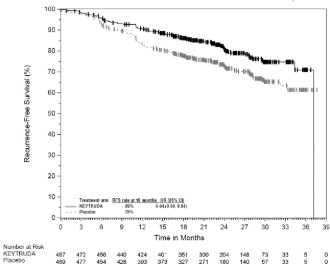
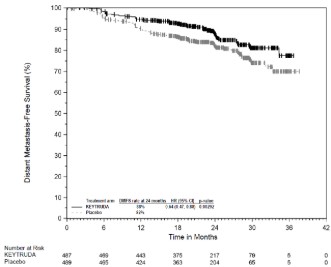
이 약의 유효성은 완전히 절제된 IIIA (1 mm 초과 림프절 전이), IIIB 또는 IIIC 흑색종 환자를 대상으로 한 다기관, 무작위 이중 맹검 위약 대조 연구인 KEYNOTE ‑054에서 평가되었다. 총 1019명의 환자가 질병이 재발하거나 허용 불가능한 독성 발생 전까지 최대 1년까지 이 약을 200 mg 3주마다 투여(n=514) 또는 위약을 투여(n=505) 하도록 무작위 배정(1:1) 되었다. 병기[AJCC 기준(IIIA vs. IIIB vs. IIIC 1 ‑3개 양성 림프절 vs. IIIC 4개 이상 양성 림프절)] 및 지리적 영역(북미, 유럽 국가, 호주 및 기타 지정 국가)에 의해 층화되었다. 환자는 치료를 시작하기 전 13주 이내에 림프절 절제술을 받아야 하며, 지시가 있을 경우에 방사선 치료를 받을 수 있다. 활성 자가면역질환이 있거나 면역억제를 필요로 하거나 점막 또는 안구 흑색종을 가진 환자들은 제외되었다. 환자들은 처음 2년간 첫 번째 이 약 투여 후 12주마다, 그 후 3년에서 5년까지는 6개월마다, 그리고 그 후에는 매년 영상(imaging)을 촬영했다.
1019명의 시험 참가자의 베이스라인 특성은 다음과 같았다: 연령 중앙값(median age) 54세 (25%는 65세 이상), 남성 62%, ECOG PS 0(94%) 및 ECOG PS 1(6%)이었다. 16%는 IIIA 단계, 46%는 IIIB 단계, 18%는 IIIC 단계(1~3개 양성 림프절), 20%는 IIIC 단계(4개 이상 양성 림프절), 50%는 BRAF V600 돌연변이 양성 환자였으며 44%는 BRAF 야생형(wild ‑type)이며, IUO 분석에 따르면 84%는 TPS 1% 이상인 PD ‑L1 양성 흑색종을 가졌다.
1차 유효성 평가지표는 전체 집단 및 PD ‑L1 양성 종양을 갖는 집단에서 임상시험 연구자가 평가한 무재발 생존(RFS)이다. RFS와 DMFS 유효성 결과는 각각 표 39 및 그림 6, 그리고 표 39 및 그림 7에 요약되어 있으며 추적 관찰 기간 중앙값은 각각 16.0개월, 그리고 45.5개월이었다.
*RFS: 무작위 배정한 날짜에서 첫 번째 재발 날짜(국소, 주위 또는 원격전이) 또는 사망 중 먼저 발생한 날까지의 기간
표 39. 유효성 결과 (KEYNOTE ‑054)
|
평가 지표 |
3주마다 이 약 200 mg n=514 |
위약 n=505 |
|
무재발 생존(RFS) | ||
|
사건 발생 환자의 수 (%) |
135 (26%) |
216 (43%) |
|
중앙값 (개월) (95% CI) |
NR (NR, NR) |
20.4 (16.2, NR) |
|
위험비(HR)*(98% CI) |
0.57 (0.43, 0.74) | |
|
p-값 (층화 된 로그 순위) |
<0.0001 | |
|
무원격전이 생존(DMFS) | ||
|
사건 발생 환자의 수 (%) |
173 (34%) |
245 (49%) |
|
중앙값 (개월) (95% CI) |
NR (49.6, NR) |
40.0 (27.7, NR) |
|
위험비(HR)* (95% CI) |
0.60 (0.49, 0.73) | |
|
p-값 (층화 된 로그 순위) |
<0.0001 | |
|
*층화된 Cox 비례 위험 모형에 기초함 NR = 도달하지 않음 | ||
그림 6. KEYNOTE ‑054의 무재발 생존(RFS) Kaplan ‑Meier 곡선 (ITT 집단)
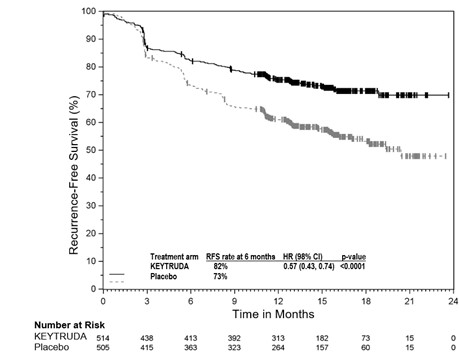
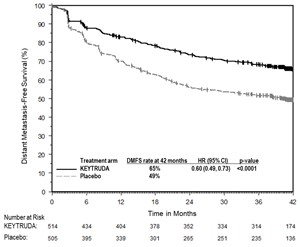
KEYNOTE ‑189: 치료 경험이 없는 비편평 비소세포폐암 환자 대상의 병용 요법 대조 임상시험
페메트렉시드 및 백금 화학요법을 병용한 이 약의 유효성은 다기관, 무작위 배정, 활성 대조군, 이중 맹검 임상시험인 KEYNOTE ‑189에서 평가되었다. 주요 대상 환자 선정 기준은 전이성 비편평 비소세포폐암 환자이고, 이전에 전이성 비소세포폐암에 대한 전신 요법을 받지 않았으며, EGFR 또는 ALK 변이가 없는 환자이다. 2년 간의 치료 동안 전신 치료가 필요한 자가면역질환 환자, 면역 억제 치료가 필요한 환자, 또는 이전 26주 이내에 30 Gy 이상의 흉부방사선을 받은 환자는 제외되었다. 환자들은 시험군 또는 대조군에 무작위로(2:1) 배정되었다:
▪ 이 약 200 mg 또는 위약, 페메트렉시드 500 mg/m2 및 시스플라틴 75 mg/m2 또는 카보플라틴 AUC 5 mg/mL/min을 3주마다 4 사이클 동안 정맥투여 한 후에, 이 약 200 mg 또는 위약, 페메트렉시드 500 mg/m2를 3주마다 정맥투여 하였다.
이 약은 RECIST 1.1에 따라 연구진이 평가한 질병의 진행이 확인되기 전, 허용 불가능한 독성 발생 전, 또는 최대 24개월까지 투여되었다. 환자가 임상적으로 안정적이고 연구자에 의해 임상적 이익이 있다고 판단되는 경우 질병 진행 및 페메트렉시드 중단 후에도 이 약을 투여받았다. 24개월의 치료를 완료했거나 완전 반응을 보인 환자에 대해서는 질병이 진행될 경우 이 약을 최대 1년까지 추가 투여할 수 있었다. 종양 상태에 대한 평가는 6주차, 12주차, 그리고 그 후 9주마다 수행되었다. 위약 및 화학요법을 받는 환자 중에서 독립적 평가시 질병이 진행된 경우 환자들에게는 이 약이 단독 요법으로 제공되었다.
KEYNOTE ‑189의 616명(410명의 이 약과 화학요법군 및 206명의 위약과 화학요법군)의 시험 참가자 베이스라인 특성은 다음과 같았다. 연령 중앙값(median age) 64세(65세 이상 49%), 남성 59%, 백인 94%, 동양인 3%, ECOG PS 0(43%) 및 1(56%), 31%는 종양 PD ‑L1 발현 TPS 1% 미만 및 18%는 치료여부와는 관계없이 뇌 전이 이력이 있었다. 최종 분석 시점에서, 위약 및 화학요법군의 총 84명의 환자가 질병 진행시 이 약 단독 요법으로 교차 투여받았으며, 29명의 환자는 후속 요법으로 관문 억제제를 투여 받았다.
1차 유효성 평가지표는 전체생존(OS)과 무진행생존(PFS, RECIST 1.1에 따른 눈가림된 독립중앙평가(BICR)에 근거)이었다. 2차 유효성 평가지표는 RECIST 1.1에 따른 BICR에 근거한 객관적 반응률(ORR) 및 반응지속기간(DoR)이었다. 주요 유효성 결과는 표 40에 요약되어 있다.
표 40. 비편평 비소세포폐암 환자에 대한 이 약, 페메트렉시드 및 백금 화학요법제 치료 후 유효성 결과 (KEYNOTE ‑189)
|
평가 지표 |
이 약 + 페메트렉시드 + 백금 화학요법제 n=410 |
위약 + 페메트렉시드 + 백금 화학요법제 n=206 |
|
전체생존(OS)* | ||
|
사건 발생 환자 수 (%) |
258 (63%) |
163 (79%) |
|
중앙값(개월) (95% CI) |
22.0 (19.5, 24.5) |
10.6 (8.7, 13.6) |
|
위험비(HR)†(95% CI) |
0.56 (0.46, 0.69) | |
|
p-값‡ |
<0.00001 | |
|
무진행생존(PFS)* | ||
|
사건 발생 환자 수 (%) |
337 (82%) |
197 (96%) |
|
중앙값(개월) (95% CI) |
9.0 (8.1, 10.4) |
4.9 (4.7, 5.5) |
|
위험비(HR)†(95% CI) |
0.49 (0.41, 0.59) | |
|
p-값‡ |
<0.00001 | |
|
객관적 반응률(ORR)§ | ||
|
객관적 반응률(ORR)¶% (95% CI) |
48% (43, 53) |
19% (14, 25) |
|
p-값# |
<0.0001 | |
|
반응지속기간(DoR)§ | ||
|
중앙값(개월) (범위) |
11.2 (1.1+, 18.0+) |
7.8 (2.1+, 16.4+) |
|
*최종 분석에 기초함 †층화된 Cox 비례 위험 모형에 기초한 위험비(HR) ‡층화된 로그 순위 테스트 (log-rank test)에 기초함 §1차 중간 분석에 기초함 ¶완전반응(CR) 또는 부분반응(PR)을 보인 최상의 객관적 반응 환자를 기준으로 함 #PD-L1 상태, 백금 화학요법 및 흡연 상태에 의해 층화 된 Miettinen & Nurminen 방법에 기초함 | ||
이 연구는 이 약과 백금화학요법 및 페메트렉시드 병용 투여시 백금화학요법 및 페메트렉시드 대비 OS, PFS 및 ORR에 대한 통계적으로 유의미한 개선을 입증하였다.
그림 8. KEYNOTE ‑189 치료군의 전체생존(OS) Kaplan ‑Meier 곡선 (ITT 집단)
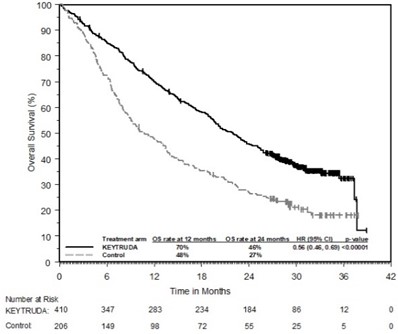
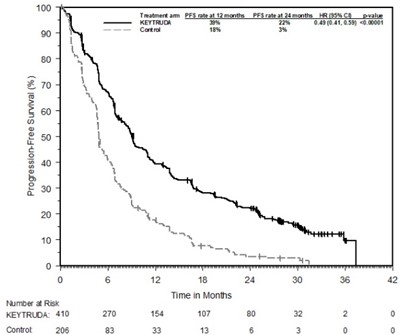
카보플라틴과 파클리탁셀 혹은 알부민 결합 파클리탁셀과 병용한 이 약의 유효성은 무작위 배정, 이중 맹검, 다기관, 위약 대조 임상시험인 KEYNOTE ‑407에서 평가되었다. 이 임상시험의 주요 대상 환자 선정 기준은 PD ‑L1 종양 발현에 관계없이 전이성 편평 비소세포폐암 환자이며, 이전에 전이성 암에 대한 전신 요법을 받지 않은 환자이다. 2년 간의 치료 동안 전신 치료가 필요한 자가면역질환 환자, 면역 억제가 필요한 환자, 또는 이전 26주 이내에 30 Gy 이상의 흉부방사선을 받은 환자는 제외되었다. 종양 PD ‑L1 발현 (TPS 1% 미만 [음성] vs. TPS 1% 이상), 대조약 선택(파클리탁셀 또는 알부민 결합 파클리탁셀) 및 지리적 영역(동아시아 vs. 비동아시아)에 의해 층화되었다. 환자들은 시험군 또는 대조군에 무작위(1:1) 배정되었다. 연구에 사용된 약물은 모두 정맥 투여되었다.
▪ 이 약 200 mg 또는 위약 및 카보플라틴 AUC 6 mg/mL/min은 21일 주기의 1일차에 4 사이클 동안, 그리고 파클리탁셀 200 mg/m2를 21일 주기의 1일차에 4 사이클 동안, 또는 알부민 결합 파클리탁셀 100 mg/m2를 21일 주기 1일차, 8일차, 15일차에 4 사이클 동안 투여 한 후에, 이 약 200 mg 또는 위약을 3주마다 투여한다. 이 약은 1일차 화학요법 전에 투여한다.
이 약 또는 위약 치료는 RECIST 1.1에 따른 BICR 평가에 근거한 질병의 진행이 확인되기 전, 허용 불가능한 독성 발생 전, 또는 최대 24개월까지 계속 진행되었다. 환자가 임상적으로 안정적이고 연구자에 의해 임상적 이익이 있다고 판단되는 경우 질병 진행 후에도 이 약을 투여받았다. 후속 질병 진행 시 이 약을 사용한 치료를 재개하고 최대 1년까지 추가 투여할 수 있었다.
위약군 환자들 중 질병 진행이 확인된 경우 이 약을 단독 요법으로 교차 투여하였다.
종양 상태에 대한 평가는 18주까지는 6주마다, 45주까지는 9주마다, 그리고 이후에는 12주마다 수행되었다. 일차 유효성 평가지표는 RECIST 1.1에 따라 눈가림된 독립중앙평가(BICR)에 근거한 무진행생존(PFS) 및 전체생존(OS)이었다. 추가 유효성 평가지표는 RECIST 1.1에 따른 BICR 평가에 근거한 객관적 반응률(ORR) 및 반응지속기간(DoR)이었다.
전체 559명의 환자가 무작위 배정(278명의 환자는 이 약, 281명은 위약)되었다. 대상 환자군 특성은 다음과 같다. 연령 중앙값 65세 (범위: 29~88), 65세 이상 55%, 남성 81%, 백인 77%, ECOG PS 0(29%) 및 1(71%) 그리고 뇌 전이 이력이 있는 환자 8%였다. 35%는 종양 PD ‑L1 발현 TPS 1% 미만[음성]이었다. 19%는 동아시아에 거주하며, 60%는 파클리탁셀을 투여 받았다.
주요 유효성 결과는 표 41에 요약되어 있다.
표 41. 유효성 결과 (KEYNOTE ‑407)
|
평가 지표 |
이 약 카보플라틴 파클리탁셀/알부민 결합 파클리탁셀 n=278 |
위약 카보플라틴 파클리탁셀/알부민 결합 파클리탁셀 n=281 |
|
전체생존(OS)* |
| |
|
사건 발생 수 (%) |
168 (60%) |
197 (70%) |
|
중앙값(개월) (95% CI) |
17.1 (14.4, 19.9) |
11.6 (10.1, 13.7) |
|
위험비(HR)†(95% CI) |
0.71 (0.58, 0.88) | |
|
p-값 (층화된 로그 순위) |
0.0006 | |
|
무진행생존(PFS)* |
| |
|
사건 발생 수 (%) |
217 (78%) |
252 (90%) |
|
중앙값(개월) (95% CI) |
8.0 (6.3, 8.4) |
5.1 (4.3, 6.0) |
|
위험비(HR)†(95% CI) |
0.57 (0.47, 0.69) | |
|
p-값 (층화된 로그 순위) |
<0.0001 | |
|
객관적 반응률(ORR)‡ |
| |
|
객관적 반응률(ORR)§ |
58% |
38% |
|
(95% CI) |
(52, 64) |
(33, 44) |
|
반응지속기간(DoR)‡ |
| |
|
반응지속기간(DoR) 중앙값(개월) (범위) |
7.7 (1.1+, 14.7+) |
4.8 (1.3+, 15.8+) |
|
*최종 분석에 기초함 †층화된 Cox 비례 위험 모형에 기초한 위험비(HR) ‡2차 중간 분석에 기초함 §초기 중간 분석 (이 약 병용 요법의 경우 n=101, 위약의 경우 n=102)에서 통계적으로 유의미한 차이가 관찰되었다; 위약에 대한 객관적 반응률(ORR)은 58 %[95% CI (48, 68)] 및 35 %[95% CI (26, 45)], p=0.0004이었다. | ||
이 연구는 이 약과 카보플라틴 및 파클리탁셀(또는 알부민 결합 파클리탁셀) 병용 투여시 위약과 카보플라틴 및 파클리탁셀(또는 알부민 결합 파클리탁셀) 투여 대비 OS, PFS 및 ORR에 대한 통계적으로 유의미한 개선을 입증하였다.
그림 10. KEYNOTE ‑407의 전체생존(OS) Kaplan ‑Meier 곡선
이전에 치료 경험이 없는 비소세포폐암 환자를 대상으로 한 이 약의 유효성은 다기관, 무작위 배정, 대조 임상시험인 KEYNOTE ‑024에서도 평가되었다. 이 임상시험의 주요 대상 환자군 선정 기준은 PD ‑L1 IHC 22C3 pharmDx™ 키트를 사용한 면역조직화학(IHC) 분석에서 종양이 TPS 50% 이상의 PD ‑L1 발현율이 높은 전이성 비소세포폐암 환자이며 이전에 전이성 암에 대한 전신 요법을 받지 않은 환자이다. EGFR 또는 ALK 변이가 있는 환자, 2년 간의 치료 동안 전신 치료가 필요한 자가면역질환 환자, 또는 이전 26주 이내에 30 Gy 이상의 흉부방사선을 받은 환자는 제외되었다.
환자들은 시험군 또는 대조군으로 무작위 배정(1:1)되었다.
▪ 이 약 200 mg을 3주마다 투여(n=154) 또는
▪ 백금 함유 화학요법 중 하나 선택하여 투여(n=151)
‑ 페메트렉시드+카보플라틴 또는 시스플라틴 투여 후 선택적으로 페메트렉시드 유지요법(비편평 비소세포폐암에만 한정)
‑ 젬시타빈+시스플라틴 또는 카보플라틴
‑ 파클리탁셀+카보플라틴 투여 후 선택적으로 페메트렉시드 유지요법(비편평 비소세포폐암에만 한정)
환자들은 질병 진행 또는 허용 불가능한 독성 발생 전까지 이 약을 투여 받았다. 환자가 임상적으로 안정적이고 연구자에 의해 임상적 이익이 있다고 판단되는 경우 질병 진행 후에도 이 약을 투여받았다. 질병이 진행되지 않은 환자의 경우 최대 24개월까지 치료받을 수 있었다. 후속 질병 진행 시 이 약을 사용한 치료를 재개하고 최대 1년까지 추가 투여할 수 있었다. 종양 상태 평가는 9주마다 진행되었다. 화학요법을 받는 환자 중에서 독립적 평가시 질병이 진행된 환자들은 이 약으로 교차하여 치료를 진행하였다.
KEYNOTE ‑024 시험 참가자 305명 중 베이스라인 특성은 다음과 같다. 연령 중앙값(median age) 65세 (65세 이상 54%), 남성 61%, 백인 82%, 및 동양인 15% 그리고 ECOG PS 0(35%) 및 1(65%)이었다. 질병의 특성은 편평세포(18%) 및 비편평세포(82%), M1(99%) 및 뇌전이(9%)였다.
1차 유효성 평가지표는 RECIST 1.1에 따른 눈가림된 독립중앙평가(BICR)에 근거한 무진행생존(PFS)였다. 2차 유효성 평가지표는 전체생존(OS) 및 객관적 반응률(ORR, RECIST 1.1에 따른 BICR 평가에 근거)이었다. 주요 유효성 측정값은 표 42에 요약 되어 있다.
표 42. 유효성 결과 (KEYNOTE ‑024)
|
평가 지표 |
3주마다 이 약 200 mg n=154 |
화학요법 n=151 |
|
무진행생존(PFS)*,† |
|
|
|
사건 발생 환자 수 (%) |
73 (47%) |
116 (77%) |
|
중앙값(개월) (95% CI) |
10.3 (6.7, NA) |
6.0 (4.2, 6.2) |
|
위험비(HR)‡(95% CI) |
0.50 (0.37, 0.68) | |
|
p-값§ |
<0.001 | |
|
전체생존(OS)¶ |
|
|
|
사건 발생 환자 수 (%) |
73 (47%) |
96 (64%) |
|
중앙값(개월) (95% CI) |
30 (18.4, NA) |
14.2 (9.8, 19.0) |
|
위험비(HR)‡(95% CI) |
0.63 (0.47, 0.86) | |
|
p-값§ |
0.002 | |
|
객관적 반응률(ORR)*,† |
|
|
|
객관적 반응률(ORR) % (95% CI) |
45% (37, 53) |
28% (21, 36) |
|
반응지속기간(DoR)*,#,Þ |
|
|
|
중앙값(개월) (범위) |
도달하지 않음 (1.9+, 14.5+) |
6.3 (2.1+, 12.6+) |
|
*중간 분석에 기초함 †RECIST 1.1에 따른 BICR 평가에 근거함 ‡층화된 Cox 비례 위험 모형에 기초한 위험비(HR)(화학요법 대비 이 약) §층화된 로그 순위 테스트(log-rank test)에 기초함 ¶최종 분석에 기초함 #최종 분석에서 확인된 완전반응(CR) 또는 부분반응(PR)을 보인 최상의 객관적 반응 환자를 기준으로 함 ÞKaplan-Meier 추정 분석에 기초함 NA = 가용하지 않음 | ||
이 연구는 이 약 200mg을 3주마다 투여시 화학요법 대비 OS 및 PFS에 대한 통계적으로 유의미한 개선을 입증하였다.
그림 12. KEYNOTE ‑024 대조군의 무진행 생존(PFS) Kaplan ‑Meier 곡선 (ITT 집단)

이 약의 유효성은 다기관, 무작위 배정, 대조 임상시험인 KEYNOTE ‑010에서 평가되었다. 주요 대상 환자군 선정 기준은 백금 기반 화학요법제 치료 이후 진행된 비소세포폐암으로, 적절한 경우 ALK 또는 EGFR 변이에 대한 표적 치료 진행, 및 PD ‑L1 IHC 22C3 pharmDx™ 키트를 사용한 임상시험 분석에 의해 PD ‑L1 TPS 1% 이상이었다. 자가면역 질환 환자, 면역 억제 치료가 필요한 환자 및 연구 시작 26주 이내에 30 Gy 이상의 흉부방사선을 받은 환자는 제외되었다. 환자들은 이 약 2 mg/kg(n=344) 또는 10 mg/kg(n=346)을 3주마다 투여 받거나 도세탁셀 75 mg/m2를 3주마다 투여(n=343) 받도록 무작위 배정(1:1:1) 되었다. 환자들은 허용 불가능한 독성이 발생되거나 질병의 진행이 확인되기 전까지 이 약 치료를 지속하였다. 종양 상태에 대한 평가는 9주마다 진행되었다.
KEYNOTE ‑010 참가자 1033명의 베이스라인 특성은 다음과 같다. 연령 중앙값(median age) 63세(65세 이상 42%), 남성 61%, 백인 72% 및 동양인 21%, 그리고 ECOG PS 0(34%) 및 1(66%)이었다. 질병의 특성은 편평세포(21%) 및 비편평세포(70%), M1 (91%), 뇌전이(15%)이었다. EGFR(8%) 또는 ALK(1%) 유전적 변이가 있었다. 모든 환자가 이전의 치료로서 백금 기반 이중화학요법을 받았으며, 한 가지(69%), 또는 두 가지 이상(29%)의 이전 치료를 받았다.
1차 유효성 평가지표는 RECIST 1.1에 따른 눈가림된 독립중앙평가(BICR)에 근거한 전체생존(OS) 및 무진행생존(PFS)였다. 2차 유효성 평가지표는 객관적반응률(ORR) 및 반응지속기간(DoR)이었다. 주요 유효성 결과는 표 43에 요약되어 있다.
표 43. 이전에 치료된 비소세포폐암 환자 대상으로 3주마다 이 약 2 또는 10 mg/kg 투여 시 유효성 결과 (KEYNOTE ‑010)
|
평가 지표 |
이 약 2 mg/kg 3주마다 |
이 약 10 mg/kg 3주마다 |
도세탁셀 75 mg/m23주마다 |
|
TPS ≥ 1% |
|
|
|
|
환자 수 |
344 |
346 |
343 |
|
전체생존(OS) |
|
|
|
|
사건 발생 환자 수 (%) |
172 (50%) |
156 (45%) |
193 (56%) |
|
중앙값(개월) (95% CI) |
10.4 (9.4, 11.9) |
12.7 (10.0, 17.3) |
8.5 (7.5, 9.8) |
|
위험비(HR)*(95% CI) |
0.71 (0.58, 0.88) |
0.61 (0.49, 0.75) |
- |
|
p-값† |
<0.001 |
<0.001 |
- |
|
무진행생존(PFS)‡ |
|
|
|
|
사건 발생 환자 수 (%) |
266 (77%) |
255 (74%) |
257 (75%) |
|
중앙값(개월) (95% CI) |
3.9 (3.1, 4.1) |
4.0 (2.6, 4.3) |
4.0 (3.1, 4.2) |
|
위험비(HR)*(95% CI) |
0.88 (0.73, 1.04) |
0.79 (0.66, 0.94) |
- |
|
p-값† |
0.068 |
0.005 |
- |
|
객관적 반응률(ORR)‡ |
|
|
|
|
객관적 반응률(ORR) %§(95% CI) |
18% (14, 23) |
18% (15, 23) |
9% (7, 13) |
|
반응지속기간(DoR)‡,¶ |
|
|
|
|
중앙값(개월) (범위) |
도달하지 않음 (0.7+, 20.1+) |
도달하지 않음 (2.1+, 17.8+) |
6.2 (1.4+, 8.8+) |
|
*층화된 Cox 비례 위험 모형에 기초한 위험비(HR)(도세탁셀 대비 이 약) †층화된 로그 순위 테스트(log-rank test)에 기초함 ‡RECIST 1.1에 따른 BICR 평가에 근거함 §모든 반응은 부분반응(PR)임 ¶완전반응(CR) 또는 부분반응(PR)을 보인 최상의 객관적 반응 환자를 기준으로 함 | |||
이 연구는 이 약 2mg/kg 또는 10mg/kg을 3주마다 투여시 화학요법 대비 OS에 대한 통계적으로 유의미한 개선을 입증하였다.
그림 14. KEYNOTE ‑010(TPS ≧ 1%) 대조군의 전체생존(OS) Kaplan ‑Meier 곡선 (ITT 집단)
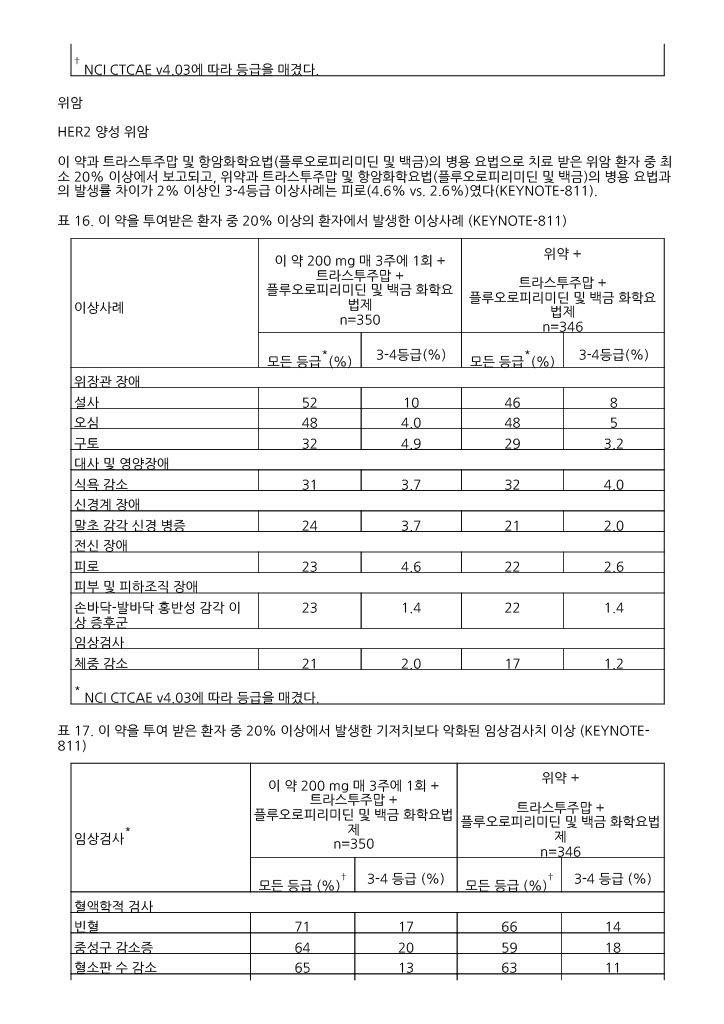
수술 전 보조요법으로서 항암화학요법과의 병용 요법 후 수술, 그리고 이어서 수술 후 보조요법으로서 단독 요법으로 투여한 이 약의 유효성은 이전의 치료 경험이 없는 절제 가능한 II기, IIIA기, 또는 IIIB기(N2) 비소세포폐암(AJCC 8판 기준) 환자 총 797명에 대한 다기관, 무작위 배정, 이중 맹검, 위약 대조 임상시험인 KEYNOTE ‑671에서 평가되었다. 환자들은 종양 PD ‑L1 발현에 관계없이 모집되었다. 2년 이내 전신 치료가 필요했던 활성 자가면역질환 또는 면역 억제를 필요로 하는 의학적 상태를 가진 환자, 또는 스테로이드 투여를 필요로 했던 간질성 폐 질환이나 폐염증 병력이 있는 환자는 제외되었다. 무작위배정은 질병진행 단계(II기 vs. III기), 종양 PD ‑L1 발현(TPS ≧50% 또는 <50%), 조직학(편평 vs. 비편평), 및 지리적 영역(동아시아 vs. 동아시아 외)에 따라 층화되었다.
환자들은 아래 치료군 중 하나에 무작위 배정(1:1)되었다:
치료군 A: 수술 전 요법으로 매 3주마다 1일차에 이 약 200 mg을 시스플라틴 75 mg/m2 및 페메트렉시드 500 mg/m2(1일차) 또는 젬시타빈 1000 mg/m2(1일차와 8일차)과 병용하여 최대 4주기까지 투여한다. 수술 후 4 ‑12주 이내, 매 3주마다 이 약 200 mg을 최대 13주기까지 투여한다.
치료군 B: 수술 전 요법으로 매 3주마다 1일차에 위약을 시스플라틴 75 mg/m2 및 페메트렉시드 500 mg/m2(1일차) 또는 젬시타빈 1000 mg/m2(1일차와 8일차)과 병용하여 최대 4주기까지 투여한다. 수술 후 4 ‑12주 이내, 매 3주마다 위약을 최대 13주기까지 투여한다.
연구에 사용된 약물들은 모두 정맥 투여되었다. 이 약 또는 위약을 사용한 치료는 치료 완료(17주기), 근치적 수술을 불가능하게 하는 질병 진행, 수술 후 보조요법 단계에서의 질병 재발, 수술을 하지 않았거나 불완전 절제 이후 수술 후 보조요법 단계로 진입한 상태에서의 질병 진행, 또는 허용 불가능한 독성 발생 전까지 지속되었다. 종양 상태에 대한 평가는 수술 전 보조요법 단계에서 기저치, 7주차 및 13주차에 수행되었고 수술 후 보조요법 단계에서 치료 시작 전 4주 이내에 수행되었다. 수술 후 보조요법 치료를 시작한 후, 종양 상태에 대한 평가는 3년까지는 매 16주마다, 그 이후에는 매 6개월마다 수행되었다.
임상시험은 치료요법의 각 단계(수술 전 보조요법 또는 수술 후 보조요법)에서 이 약의 효과를 구분할 수 있도록 설계되지 않았다.
주요 유효성 평가지표는 전체생존(OS) 및 연구자가 평가한 무사건생존(EFS)이었다. 추가 유효성 평가지표는 눈가림된 독립병리학평가(BIPR)에 근거한 병리학적 완전반응(pCR) 비율과 주요 병리학적 반응(mPR) 비율이었다.
연구 모집단 특성은 다음과 같았다: 연령 중앙값 64세(범위: 26 ‑83세), 65세 이상 45%; 75세 이상 7%; 남성 71%; 백인 61%, 동양인 31%, 및 흑인 2%, 인종 미보고 4%; 히스패닉 또는 라틴계 9%. ECOG PS는 63% 및 37%에서 각각 0 또는 1이었다; 종합 병기 II기 30% 및 III기 70%; TPS 50% 이상 33% 및 TPS 50% 미만 67%; 편평 조직학을 지닌 종양 43% 및 비편평 조직학을 지닌 종양 57%; 동아시아 지역의 환자 31%였다.
이 약과 백금 기반 항암화학요법을 병용투여한 군에 속한 환자의 81%가 근치적 수술을 받은 것과 비교하여 위약과 백금 기반 항암화학요법을 병용투여한 군에 속한 환자의 76%가 근치적 수술을 받았다.
이 연구는 이 약과 백금 기반 항암화학요법 병용 요법에 이어 이 약 단독 요법을 투여 받은 환자에서 위약과 백금 기반 항암화학요법에 이어 위약 단독 요법을 투여받은 환자에 비해 OS 및 EFS에 대한 통계적으로 유의미한 개선을 입증했다.
유효성 결과는 표 44 및 그림 15에 요약되어 있다.
표 44. 유효성 결과(KEYNOTE ‑671)
|
평가지표 |
항암화학요법과 병용하여 매 3주마다 이 약 200 mg/이 약 n=397 |
항암화학요법과 병용하여 위약/위약 n=400 |
|
전체생존(OS) | ||
|
사건 발생 환자 수(%) |
110 (28%) |
144 (36%) |
|
중앙값(개월)*(95% CI) |
NR (NR, NR) |
52.4 (45.7, NR) |
|
위험비(HR)†(95% CI) |
0.72 (0.56, 0.93) | |
|
p-값‡,§ |
0.0103 | |
|
무사건생존(EFS) | ||
|
사건 발생 환자 수(%) |
139 (35%) |
205 (51%) |
|
중앙값(개월)*(95% CI) |
NR (34.1, NR) |
17.0 (14.3, 22.0) |
|
위험비(HR)†(95% CI) |
0.58 (0.46, 0.72) | |
|
p-값‡,¶ |
< 0.0001 | |
|
* Kaplan-Meier 추정에 기초함 † 치료를 질병진행 단계, 종양 PD-L1 발현, 조직학 및 지리적 영역에 의해 층화된 공변량으로 하는 Cox 회귀 모델에 기초함 ‡ 층화된 로그 순위 테스트(log-rank test)에 기초함 § 양측 p-값 경계인 0.0109와 비교함 ¶ 양측 p-값 경계인 0.0092와 비교함 NR = 도달하지 않음 | ||
그림 15. KEYNOTE ‑671의 전체생존(OS) Kaplan ‑Meier 곡선
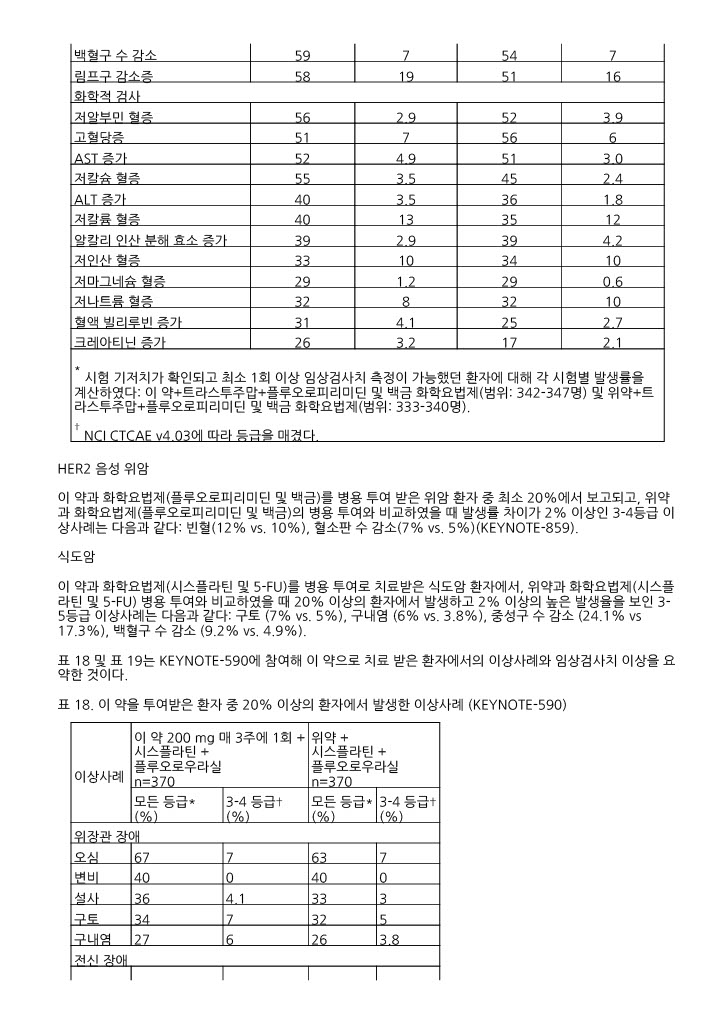
이 약의 유효성은 다기관, 무작위 배정, 삼중 맹검, 위약 대조 임상시험인 KEYNOTE ‑091에서 평가되었다. 주요 대상 환자군 선정 기준은 AJCC 7차 개정판에 따라 완전 절제술을 받은 IB기(T2a ≧ 4cm), II기 또는 IIIA기 비소세포폐암이었으며, PD ‑L1 종양 발현 상태에 관계없이 현재의 악성 종양에 대하여 이전의 수술 전 보조요법(neoadjuvant)으로서 방사선 치료 및/또는 화학요법제 치료의 경험이 없으면서 수술 후 보조요법(adjuvant)으로서 방사선 치료 경험과 계획이 없어야 했다. 환자들은 수술 후 보조요법(adjuvant)으로서 화학요법제 치료를 받았거나 받지 않았을 수도 있었다. 2년 이내 전신 치료가 필요했던 자가면역질환, 즉 면역 억제를 필요로 하는 의학적 상태를 가진 환자 또는 4주기 이상의 수술 후 보조요법(adjuvant)으로서 화학요법제 치료를 받은 환자는 임상시험 대상에서 제외되었다. 무작위 배정은 질병진행 단계(IB vs. II vs. IIIA), 수술 후 보조요법(adjuvant)으로서 화학요법제 치료 시행 유무(수술 후 보조 화학요법제 치료 경험 없음 vs 수술 후 보조 화학요법제 치료 경험 있음), PD ‑L1 발현 상태 (TPS < 1% [음성] vs. TPS 1 ‑49% vs. TPS ≧ 50%) 및 지리적 영역(서유럽 vs. 동유럽 vs. 아시아 vs. 기타 국가들)에 의해 층화되었다. 환자들은 이 약 200mg 또는 위약을 3주마다 정맥주사로 투여받도록 무작위 배정(1:1)되었다.
이 약은 RECIST 1.1에 따라 연구진이 평가한 질병의 재발이 확인되기 전, 허용 불가능한 독성 발생 전, 또는 대략 1년(18회 투여) 까지 투여되었다. 환자들은 첫 해에 이 약을 처음 투여한 후 12주마다, 그 후 2년에서 3년까지는 6개월마다, 그리고 그 후에 최대 5년까지는 매년 영상(imaging)을 촬영했다. 5년 이후에는 현지 관리 기준에 따라 영상이 촬영되었다.
무작위 배정된 환자 1177명 중 1010명(86%)이 절제술을 받은 뒤 수술 후 보조요법(adjuvant)으로서 백금 기반 화학요법제 치료를 받았다. 이 1010명의 환자들의 연령 중앙값은 64세(범위: 35~84세), 65세 이상은 49%, 남성이 68%, 백인이 77%, 아시아인이 18%, 현재 또는 과거 흡연자가 86%였으며 39%는 1의 ECOG PS를 보였다. 12%는 IB기, 57%는 II기, 31%는 IIIA기 질환이었다. 39%는 PD ‑L1 종양 발현 TPS <1% [음성]이었고, 33%는 TPS 1~49%, 28%는 TPS ≧50% 이었다. 52%는 서유럽, 20%는 동유럽, 17%는 아시아, 11%는 기타 국가 출신이었다.
1차 유효성 평가지표는 전체 모집 인원 및 PD ‑L1 종양 발현 TPS ≧50%인 환자군에서 연구자에 의해 평가된 무질병 생존(DFS)이었다. DFS는 무작위 배정된 날로부터 첫 번째 재발 시간(국소/지역적 재발, 원격 전이), 두 번째 악성 종양 또는 사망 중 가장 먼저 발생한 날까지로 정의되었다. 2차 유효성 평가지표는 PD ‑L1 종양 발현 TPS ≧1%인 환자군에서 연구자에 의해 평가된 DFS와 전체 모집 인원과 PD ‑L1 종양 발현 TPS ≧50% 및 TPS ≧1%인 환자군의 OS였다.
추적 관찰 기간 중앙값이 46.7개월(범위: 0.6~84.2개월)인 최종 DFS 분석에서 수술 후 보조요법(adjuvant)으로서 화학요법제 치료를 받은 환자들의 유효성 결과는 표 45 및 그림 16에 요약되어 있다. 분석 당시 OS 결과는 아직 성숙되지 않았다(전체 모집인원에서 사전 지정된 OS 사건의 58%만 발생).
표 45. 수술 후 보조요법(adjuvant)으로서 화학요법제 치료를 받은 환자들의 유효성 결과 (KEYNOTE ‑091)
|
평가 지표 |
이 약 200mg 3주마다 n=506 |
위약 n=504 |
|
무질병 생존 (DFS) | ||
|
사건 발생 환자 수 (%) |
225 (44%) |
262 (52%) |
|
중앙값(개월) (95% CI) |
53.8 (46.2, 70.4) |
40.5 (32.9, 47.4) |
|
위험비(HR)* (95% CI) |
0.76 (0.64, 0.91) | |
|
p-값‡ |
0.00150 | |
* 다변량 Cox 회귀모델에 기초 함
‡ 다변량 Cox 회귀 모델에서 Wald 테스트를 기반으로 한 단측(one ‑sided) 명목적 p ‑값
그림 16. KEYNOTE ‑091에서 수술 후 보조요법(adjuvant)으로서 화학요법제 치료를 받은 환자들의 무질병 생존(DFS) Kaplan ‑Meier 곡선
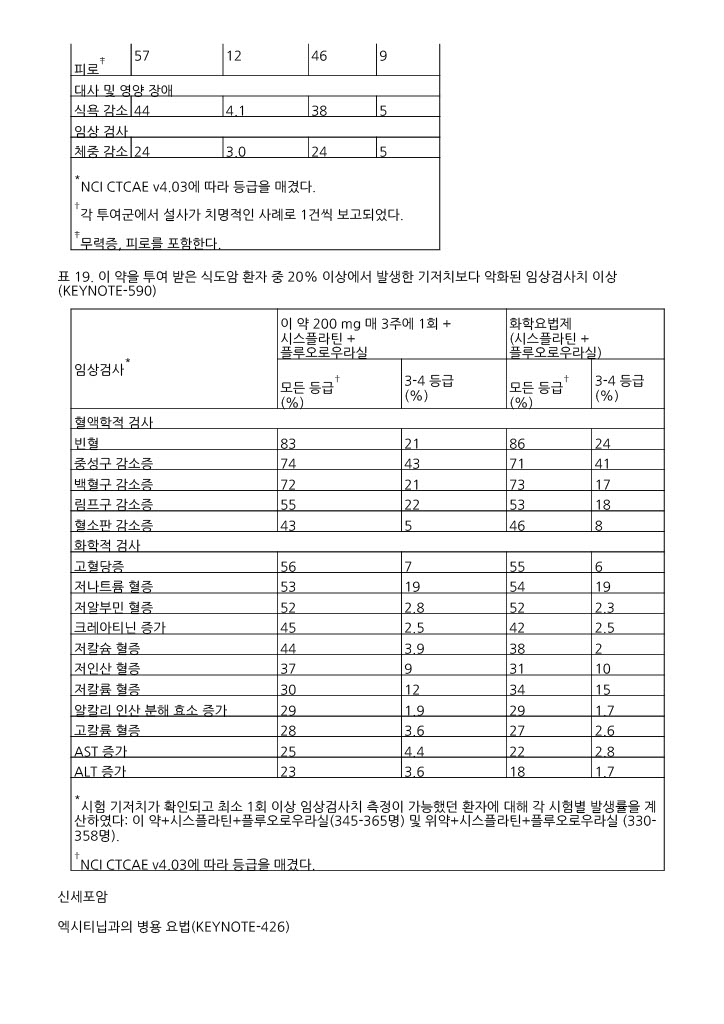
KEYNOTE ‑483: 수술이 불가능한 진행성 또는 전이성 악성 흉막 중피종 환자에서의 병용 요법 대조 연구
이 약과 페메트렉시드 및 백금 화학요법과의 병용요법에 대한 유효성은 이전에 진행성/전이성 질환에 대한 전신 치료를 받지 않은 수술이 불가능한 진행성 또는 전이성 악성 흉막 중피종 환자 440명을 대상으로 한 다기관, 무작위 배정, 공개, 활성 ‑대조 연구인 KEYNOTE ‑483에서 조사되었다. 환자들은 PD ‑L1 발현 여부와 관계 없이 등록되었다.
지난 3년 이내 전신 치료가 필요했던 자가면역질환 환자 또는 면역 억제를 필요로 하는 의학적 상태를 가진 환자는 제외되었다. 무작위 배정은 조직학적 하위 분류(상피모양(epithelioid) vs. 비 ‑상피모양(non ‑epithelioid))로 층화되었다.
환자들은 다음의 두 군 중 하나로 무작위 배정(1:1)되었고, 모든 연구 약물은 정맥 점적 주입으로 투여되었다.
▪ 매 21일마다 1일차에 이 약 200mg 및 페메트렉시드 500mg/m2 + 시스플라틴 75mg/m2 또는 카보플라틴 AUC 5 ‑6 mg/mL/min 최대 6주기까지 투여 후, 매 3주마다 이 약 200mg을 투여한다. 이 약은 1일차에 화학요법보다 먼저 투여되었다.
▪ 매 21일마다 1일차에 페메트렉시드 500mg/m2 + 시스플라틴 75mg/m2 또는 카보플라틴 AUC 5 ‑6 mg/mL/min 최대 6주기까지 투여한다.
이 약의 치료는 허용 불가능한 독성 발생 전, 중피종에 대한 수정된 RECIST 1.1(mRECIST)에 따라 연구자가 평가한 질병 진행이 확인되기 전, 또는 최대 24개월까지 계속 진행되었다. 종양 상태에 대한 평가는 첫 18주까지는 6주마다, 이후에는 12주마다 수행되었다. 주요 유효성 평가지표는 전체 생존(OS)이었다. 추가 유효성 평가지표는 mRECIST에 따른 눈가림된 독립중앙평가(BICR)에 의해 평가된 무진행 생존(PFS), 객관적 반응률(ORR) 및 반응지속기간(DOR)이었다.
이 연구의 인구학적 특성은 다음과 같다: 연령 중앙값 70세(65세 이상 77%), 남성 76%; 백인 79%, 인종이 보고되지 않았거나 알려지지 않음 21%, 히스패닉 또는 라틴 2%, ECOG PS 1 53%. 조직학적으로 78%의 환자에서 상피모양(epithelioid), 22%의 환자에서 비 ‑상피모양(non ‑epithelioid), PD ‑L1 CPS 1이상 60% 및 PD ‑L1 CPS 1미만 30%.
이 연구는 이 약과 화학요법의 병용요법으로 무작위 배정된 치료 군에서 화학요법 단독 투여 대비 OS, PFS 및 ORR에 대한 통계적으로 유의한 개선을 입증하였다. 표 46 및 그림17은 KEYNOTE ‑483의 주요 유효성 평가 결과를 요약한 것이다.
표 46. KEYNOTE ‑483의 유효성 결과
|
평가지표 |
매 3주마다 이 약 200mg + 페메트렉시드 + 백금 화학요법 n=222 |
페메트렉시드 + 백금 화학요법
n=218 |
|
전체 생존(OS) | ||
|
사건 발생 환자 수 (%) |
167 (75%) |
175 (80%) |
|
중앙값(개월) (95% CI) |
17.3 (14.4, 21.3) |
16.1 (13.1, 18.2) |
|
위험비(HR)* (95% CI) |
0.79 (0.64, 0.98) | |
|
p-값† |
0.0162 | |
|
무진행 생존(PFS) | ||
|
사건 발생 환자 수 (%) |
190 (86%) |
166 (76%) |
|
중앙값(개월) (95% CI) |
7.1 (6.9, 8.1) |
7.1 (6.8, 7.7) |
|
위험비(HR)* (95% CI) |
0.80 (0.65, 0.99) | |
|
p-값† |
0.0194 | |
|
객관적 반응률(ORR) | ||
|
객관적 반응률(95% CI) |
52% (45.5, 59.0) |
29% (23.0, 35.4) |
|
완전 반응(%) |
1 (0.5%) |
0 (0%) |
|
부분 반응(%) |
115 (52%) |
63 (29%) |
|
p-값‡ |
<0.00001 | |
|
반응지속기간§ | ||
|
중앙값 (개월) (95% CI) |
6.9 (5.8, 8.3) |
6.8 (5.5, 8.5) |
* 층화된 Cox 비례 위험 모형에 기초함
† 층화된 로그 순위 테스트(log ‑rank test)에 기초함
치료를 무작위 배정시점에 조직학적 분류(상피모양(epithelioid) vs. 다른 조직학적 분류)에 의해 층화된 공변량으로 하는 에프론의 타이 처리 방법(Efron’s method of tie handling)을 이용한 Cox 회귀 모델을 기초로 함
‡ 무작위 배정시점에 조직학적 분류(상피모양(epithelioid) vs. 다른 조직학적 분류)에 의해 층화된 Meittinen & Nurminen 방법에 기초함
§ 완전반응(CR) 또는 부분반응(PR)을 보인 최상의 객관적 반응 환자를 기준으로 함; 이 약 병용 투여 군 116명; 화학요법 투여군 63명
그림 17. KEYNOTE ‑483에서 치료군의 전체생존(OS) Kaplan ‑Meier 곡선
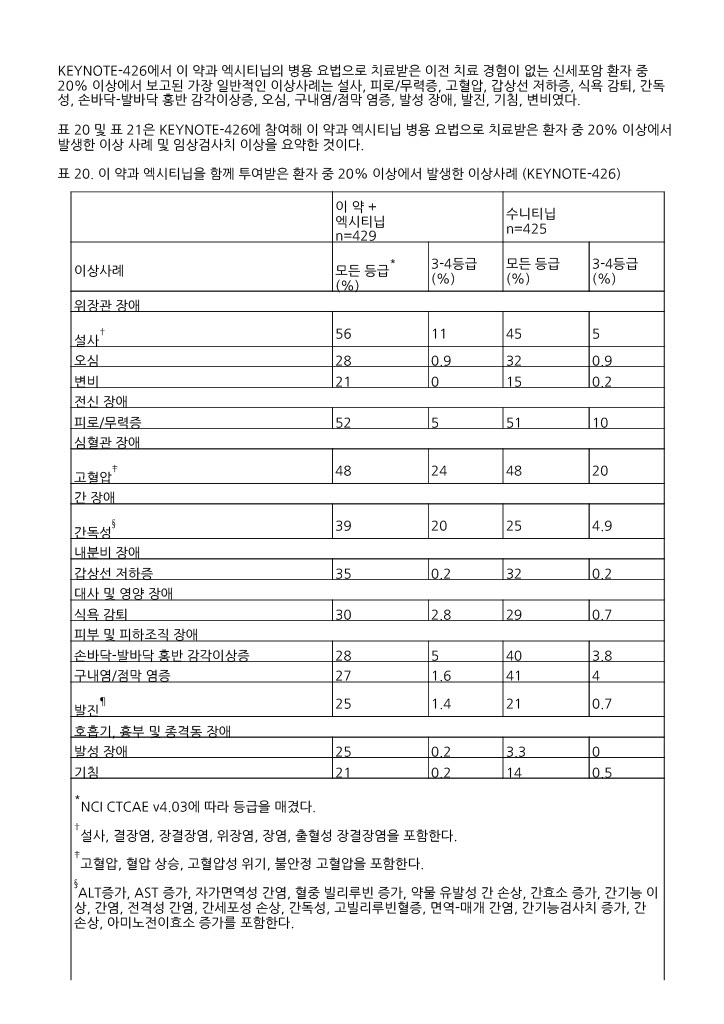
두경부암 (Head and Neck Cancer)
KEYNOTE ‑048: 두경부 편평상피세포암(Head and Neck Squamous Cell Carcinoma, HNSCC) 대상의 1차 단독 요법 또는 병용 요법 대조 임상시험
이 약의 유효성은 이전에 재발성 또는 전이성 질환에 대한 전신 요법을 받지 않았거나 국소 치료를 통해 불치 판정을 받은 전이성 또는 재발성 두경부 편평상피세포암 환자를 대상으로 다기관, 무작위 배정, 공개 임상, 활성 대조군 임상시험인 KEYNOTE ‑048에서 평가되었다. 2년 간의 치료 동안 전신 요법을 필요로 하는 활성 자가면역질환 또는 면역 억제 치료가 필요한 환자는 제외되었다. PD ‑L1 IHC 22C3 pharmDx™ 키트에 따른 종양 PD ‑L1 발현(TPS 50% 이상 또는 50% 미만), HPV 상태 (양성 또는 음성), 및 ECOG PS(0 또는 1)에 의해 층화되었다. 환자는 다음 치료군 중 하나에 1:1:1로 무작위 배정되었다.
▪ 이 약 200 mg 3주마다 투여한다.
▪ 이 약 200 mg 3주마다 1일차에 투여, 카보플라틴 AUC 5 mg/mL/min 3주마다 1일차에 또는 시스플라틴 100 mg/m2 3주마다 1일차에 투여 및 5 ‑FU 1000 mg/m2/d 4일 연속으로 3주마다 투여한다(백금과 5 ‑FU는 최대 6 사이클).
▪ 세툭시맙 400 mg/m2 투여한 후 250 mg/m2 1주마다 1회 투여, 카보플라틴 AUC 5 mg/mL/min 3주마다 투여, 또는 시스플라틴 100 mg/m2 3주마다 투여한 후, 5 ‑FU 1000 mg/m2/d 4일 연속으로 3주마다 투여한다(백금과 5 ‑FU는 최대 6 사이클).
이 약을 이용한 치료는 RECIST 1.1에 근거하여 연구자가 판단한 정의된 질병의 진행이 확인되거나, 허용 불가능한 독성이 발생되거나, 또는 최대 24 개월까지 계속 진행되었다. 환자가 임상적으로 안정적이고 연구자에 의해 임상적 이익이 있다고 판단되는 경우 질병 진행 후에도 이 약을 투여받았다. 종양 상태는 9주차에, 그리고 첫 해에는 6주마다, 그 후에는 24개월까지 9주마다 평가되었다.
총 882명의 환자 중 301명의 환자가 이 약 단독요법, 281명의 환자가 이 약 및 화학요법, 그리고 300명의 환자가 표준 치료군에 무작위 배정되었다. 임상시험 참가자의 특성은 연령 중앙값(median age) 61세(범위: 20~94세), 65세 이상 36%, 남성 83%, 백인 73%, 및 동양인 20%, ECOG PS 1(61%), 흡연이력(79%)이었다. 질병의 특성은 HPV 양성 22%, PD ‑L1 발현률 CPS 1 이상, CPS 20 이상, 및 TPS 50% 이상인 환자는 각각 85%, 43%, 및 23%이고, IV단계는 95%(IVa단계 19%, IVb단계 6%, 그리고 IVc단계 70%)이었다.
1차 유효성 평가지표는 전체생존(OS) 및 무진행생존(PFS, RECIST 1.1에 따른 눈가림된 독립중앙평가(BICR)에 근거)이었다. 2차 유효성 평가지표는 RECIST 1.1에 따른 BICR 평가에 근거한 객관적 반응률(ORR)이었다. KEYNOTE ‑048에서 이 약의 주요 유효성 결과는 표 47, 표 48 및 그림 18, 그림 19에 나타내었다.
표 47. 이 약+화학요법 병용시 유효성 결과 (KEYNOTE ‑048)
|
평가 지표 |
이 약 백금 화학요법 5-FU n=281 |
표준 치료* n=278 |
|
전체생존(OS) | ||
|
사건 발생 환자 수 (%) |
197 (70%) |
223 (80%) |
|
중앙값(개월) (95% CI) |
13.0 (10.9, 14.7) |
10.7 (9.3, 11.7) |
|
위험비(HR)†(95% CI) |
0.77 (0.63, 0.93) | |
|
p-값‡ |
0.0033 | |
|
무진행생존(PFS) | ||
|
사건 발생 환자 수 (%) |
244 (87%) |
253 (91%) |
|
중앙값(개월) (95% CI) |
4.9 (4.7, 6.0) |
5.1 (4.9, 6.0) |
|
위험비(HR)†(95% CI) |
0.92 (0.77, 1.10) | |
|
p-값‡ |
0.1697 | |
|
객관적 반응률(ORR) | ||
|
객관적 반응률(ORR)§(95% CI) |
36% (30.0, 41.5) |
36% (30.7, 42.3) |
|
p-값¶ |
0.5740 | |
|
반응지속기간(DoR) | ||
|
중앙값(개월) (범위) |
6.7 (1.6+, 30.4+) |
4.3 (1.2+, 27.9+) |
|
*세툭시맙, 백금 화학요법 및 5-FU †층화된 Cox 비례 위험 모형에 기초함 ‡층화된 로그 순위 테스트(log-rank test)에 기초함 §반응: 완전반응(CR) 또는 부분 반응(PR)으로 확인된 최상의 객관적 반응 ¶ECOG(0 vs. 1), HPV 상태(양성 vs. 음성), 및 PD-L1 상태(strongly positive vs. not strongly positive)에 의해 층화된 Miettinen & Nurminen법에 기초함 | ||
이 연구는 이 약과 백금화학요법 및 5 ‑FU 병용 투여시 표준 요법 대비 OS에 대한 통계적으로 유의미한 개선을 입증하였다.
그림 18. KEYNOTE ‑048에서 이 약+화학요법 병용 시 전체생존(OS) Kaplan ‑Meier 곡선*
표 48. CPS ≧1 및 CPS ≧20인 환자군에서의 이 약 단독 요법의 유효성 결과*(KEYNOTE ‑048)
|
평가 지표 |
CPS ≥1 |
CPS ≥20 | ||
|
|
3주마다 이 약 200 mg n=257 |
세툭시맙 백금 화학요법 FU n=255 |
3주마다 이 약 200 mg n=133 |
세툭시맙 백금 화학요법 FU n=122 |
|
전체생존(OS) | ||||
|
사건 발생 환자 수 (%) |
177 (69%) |
206 (81%) |
82 (62%) |
95 (78%) |
|
중앙값(개월) (95% CI) |
12.3 (10.8, 14.9) |
10.3 (9.0, 11.5) |
14.9 (11.6, 21.5) |
10.7 (8.8, 12.8) |
|
위험비(HR)†(95% CI) |
0.78 (0.64, 0.96) |
0.61 (0.45, 0.83) | ||
|
p-값‡ |
0.00855 |
0.00074 | ||
|
무진행생존(PFS) | ||||
|
사건 발생 환자 수 (%) |
255 (88%) |
231 (91%) |
113 (85%) |
111 (91%) |
|
중앙값(개월) (95% CI) |
3.2 (2.2, 3.4) |
5.0 (4.8, 5.8) |
3.4 (3.2, 3.8) |
5.0 (4.8, 6.2) |
|
위험비(HR)†(95% CI) |
1.15 (0.95, 1.38) |
0.97 (0.74, 1.27) | ||
|
p-값‡ |
0.91981 |
0.41028 | ||
|
객관적 반응률(ORR) | ||||
|
객관적 반응률(ORR)§(95% CI) |
19% (14.5, 24.4) |
35% (29.1, 41.1) |
23% (16.4, 31.4) |
36% (27.6, 45.3) |
|
반응지속기간(DoR) | ||||
|
중앙값(개월) (범위) |
20.9 (1.5+, 34.8+) |
4.5 (1.2+, 28.6+) |
20.9 (2.7, 34.8+) |
4.2 (1.2+, 22.3+) |
*미리 지정된 중간 분석 결과에 의함
†층화된 Cox 비례 위험 모형에 기초함
‡층화된 로그 순위 테스트(log ‑rank test)에 기초함
§반응: 완전반응(CR) 또는 부분반응(PR)으로 확인된 최상의 객관적 반응
이 연구는 CPS 1 이상 및 CPS 20 이상인 군에서 이 약 200mg을 3주마다 투여시 표준요법 대비 OS에 대한 통계적으로 유의미한 개선을 입증하였다.
그림 19. KEYNOTE ‑048에서 PD ‑L1 발현 양성(CPS ≧1)인 환자군의 이 약 단독 요법의 전체생존(OS) Kaplan ‑Meier 곡선*
KEYNOTE ‑040: 이전에 백금 기반 화학요법제로 치료받은 경험이 있는 두경부 편평상피세포암 환자 대상의 대조 임상시험
이 약의 안전성과 유효성은 구강, 인두 또는 후두의 조직학적으로 확인된 재발성 또는 전이성 두경부 편평상피세포암의 치료를 위해 유도, 동시 또는 보조요법을 포함한 백금 기반 화학요법제로 치료받는 도중 또는 이후 질병 진행을 경험하였으며 치료 의도의 국소 요법에 적합하지 않은 재발성 또는 전이성 두경부 편평상피세포암의 치료를 위한 다기관, 공개 임상, 무작위 배정, 대조 임상시험인 KEYNOTE ‑040에서 평가되었다. 환자들은 PD ‑L1 발현(TPS 50% 이상), HPV 상태 그리고 ECOG PS에 의해 층화된 뒤 무작위 배정(1:1)되었다.
이 약 200 mg 3주마다 투여(n=247)받거나 다음 세 가지 중 한 가지의 표준 요법(n=248)을 투여받았다.
▪ 1주마다 메토트렉세이트 40 mg/m2(n=64), 3주마다 도세탁셀 75 mg/m2(n=99), 또는 세툭시맙 400 mg/m2투여한 후 1주마다 250 mg/m2(n=71).
환자가 임상적으로 안정적이고 연구자에 의해 임상적 이익이 있다고 판단되는 경우 질병 진행 후에도 이 약을 투여받았다. 이 연구는 비인두암, 2년 간의 치료 동안 전신 치료가 필요한 활성 자가면역질환, 면역 억제 치료가 필요한 환자, 또는 재발성 및/또는 전이성 두경부 편평상피세포암을 위해 이전에 세 가지 이상의 전신 요법으로 치료받은 환자를 제외하였다. 종양 상태에 대한 평가는 9주차에, 그리고 52주까지 6주마다, 그 후에는 24개월까지 9주마다 진행되었다.
KEYNOTE ‑040에 무작위 배정된 495명의 환자중 PD ‑L1 IHC 22C3 pharmDx™ 키트에 의해 50% 이상의 PD ‑L1 발현 TPS를 갖는 환자들은 129명(26%)이었다. 129명의 베이스라인 특성은 다음과 같다. 연령 중앙값 62세(65세 이상 40%), 남성 81%, 백인 78%, 동양인 11%, 및 흑인 2%, ECOG PS 0(23%) 및 1(77%), 19%는 HPV 양성이었다. 67%는 M1 질병을 가졌으며 대다수는 IV단계(IV 단계 32%, IVa 단계 14%, IVb 단계 4%, 및 IVc 단계 44%)였다. 16%는 백금 기반의 수술 전 보조요법(neoadjuvant) 또는 수술 후 보조요법(adjuvant) 화학요법 치료 후에 질병 진행이 확인되었고, 84%는 전이성 질환에 대해 1 ‑2회의 이전 전신 요법을 받았다.
1차 유효성 평가지표는 ITT 집단에서의 전체생존(OS)였다. TPS 50% 이상인 환자군에서 주요 유효성 결과는 표 49에 요약되어 있다.
표 49. 이전에 백금 기반 화학요법제를 투여받은 TPS 50% 이상 두경부 편평상피세포암 환자에 대한 이 약 200 mg 3주마다 투여 후 유효성 결과 (KEYNOTE ‑040)
|
평가 지표 |
3주마다 이 약 200 mg n=64 |
표준 치료* n=65 |
|
전체생존(OS) | ||
|
사건 발생 환자 수 (%) |
41 (64) |
56 (86) |
|
중앙값(개월) (95% CI) |
11.6 (8.3, 19.5) |
6.6 (4.8, 9.2) |
|
위험비(HR)†(95% CI) |
0.53 (0.35, 0.81) | |
|
p-값‡ |
0.001 | |
|
무진행생존(PFS)§ | ||
|
사건 발생 환자 수 (%) |
52 (81) |
58 (89) |
|
중앙값(개월) (95% CI) |
3.5 (2.1, 6.3) |
2.1 (2.0, 2.4) |
|
위험비(HR)†(95% CI) |
0.58 (0.39, 0.86) | |
|
p-값‡ |
0.003 | |
|
객관적 반응률(ORR)§ | ||
|
객관적 반응률(ORR) (95% CI) |
26.6 (16.3, 39.1) |
9.2 (3.5, 19.0) |
|
p-값¶ |
0.0009 | |
|
반응지속기간(DoR)§,# | ||
|
중앙값(개월) (범위) |
도달하지 않음 (2.7, 13.8+) |
6.9 (4.2, 18.8) |
*메토트렉세이트, 도세탁셀 및 세툭시맙
†층화된 Cox 비례 위험 모형에 기초한 위험비(HR)(표준 요법 대비 이 약)
‡로그 순위 테스트에 기반한 단측(One ‑sided) p ‑값
§RECIST 1.1에 따라 BICR 평가에 근거함
¶Miettinen & Nurminen 방법에 기초함
#최종 분석에서 확인된 완전반응(CR) 또는 부분반응(PR)을 보인 최상의 객관적 반응 환자를 기준으로 함
이 연구는 TPS 50% 이상인 군에서 이 약 200mg을 3주마다 투여시 표준요법 대비 임상적으로 유의미한 결과를 보였다.
그림 20. KEYNOTE ‑040 PD ‑L1 발현(TPS 50% 이상)인 환자의 전체생존(OS) Kaplan ‑Meier 곡선
KEYNOTE ‑204: 불응성 또는 재발성의 전형적 호지킨 림프종 환자 대상의 대조 임상시험
KEYNOTE ‑204는 불응성 또는 재발성 cHL 환자 304명을 대상으로 한 무작위 배정, 공개 임상, 활성 대조군 임상시험이다. 활동성, 비 ‑감염성 폐염증 환자, 최근 5년 이내(또는 >5년이지만 GVHD의 증상이 있는 경우) 동종이형 조혈모세포이식수술(HSCT)을 받은 환자, 활성 자가면역질환 환자, 면역 억제를 필요로 하는 의학적 상태를 가지거나 전신 요법이 필요한 활동성 감염이 있는 환자는 제외되었다. 무작위 배정은 이전의 자가조혈모세포이식(Auto ‑HSCT) (예 vs. 아니오) 및 최초 치료 후 질병 상태(원발성 불응성 vs. 치료 완료 후 12개월 미만 내 재발 vs. 치료 완료 후 12개월 이상 후 재발)에 의해 층화되었다. 환자들은 다음 치료군 중 하나에 무작위 배정(1:1) 되었다.
▪ 이 약 200 mg을 3주마다 정맥 투여
▪ 브렌툭시맙 베도틴 1.8 mg/kg을 3주마다 정맥 투여
환자는 질병 진행, 또는 허용 불가능한 독성 발생 전까지 매 3주마다 이 약 200 mg을 정맥 투여받았다. 종양 상태 평가는 12주마다 실시되었다. 1차 유효성 평가지표는 2007년 개정된 IWG(International Working Group) 기준에 따른 BICR 평가에 근거한 무진행생존(PFS) 및 객관적 반응률(ORR)이었다.
KEYNOTE ‑204 환자에서 베이스라인 특성은 연령 중앙값(median age) 35세 (65세 이상 16%), 남성 57%, 백인 77%, ECOG PS 0(61%) 및 1(38%)이었다. 전형적 호지킨 림프종의 치료를 위해 투여된 이전의 치료 요법 횟수의 중앙값은 2회(범위: 1~11회)였다. 42%는 마지막 이전의 치료에 불응성이었고, 29%는 원발성 불응성 질환을 가졌다. 37% 환자가 자가조혈모세포이식(auto ‑HSCT) 경험이 있었고, 5%는 이전에 브렌툭시맙 베도틴 치료 경험이 있으며, 39%는 이전에 방사선 치료를 받았다.
이 약으로 치료받은 151명의 환자에 대한 추적 조사 중앙값은 24.9 개월(범위: 1.8~42.0개월)이었다. 유효성 결과는 표 50에 요약되어있다.
표 50. 불응성 또는 재발성 전형적 호지킨 림프종 환자의 유효성 결과
|
평가 지표 |
3주마다 이 약 200 mg n=151 |
브렌툭시맙 베도틴 1.8 mg/kg 3주마다 n=153 |
|
무진행생존(PFS) | ||
|
사건 발생 환자 수 (%) |
81 (54%) |
88 (58%) |
|
중앙값(개월) (95% CI) |
13.2 (10.9, 19.4) |
8.3 (5.7, 8.8) |
|
위험비(HR)*(95% CI) |
0.65 (0.48, 0.88) | |
|
p-값† |
0.0027 | |
|
객관적 반응률(ORR) | ||
|
객관적 반응률(ORR)‡(95% CI) |
66% (57.4, 73.1) |
54% (46.0, 62.3) |
|
완전반응(CR) |
25% |
24% |
|
부분반응(PR) |
41% |
30% |
|
p-값§ |
0.0225 | |
*Cox 비례 위험 모형에 기초함
†층화된 로그 순위 테스트 (log ‑rank test)에 기초함
‡완전반응(CR) 또는 부분반응(PR)으로 확인된 최상의 객관적 반응 환자를 기준으로 함
§Miettinen & Nurminen 방법에 기초하여 이전의 자가조혈모세포이식수술 및 질병 상태에 의해 층화됨
이 연구는 이 약 200 mg을 3주마다 투여시 브렌툭시맙 베도틴 대비 PFS에 대한 통계적 유의미한 개선을 입증하였다.
그림 21. KEYNOTE ‑204의 무진행생존(PFS) Kaplan ‑Meier 곡선
이 약의 유효성은 불응성이거나 3차 이상의 치료 이후 재발한 전형적 호지킨 림프종 환자 210명을 대상으로 한 다기관, 비무작위, 공개 임상(KEYNOTE ‑087)에서 평가되었다. PD ‑L1 발현에 관계없이 모든 환자를 포함하였다. 활동성, 비 감염성 폐염증 환자, 최근 5년 이내(또는 5년 이상이지만 GVHD의 증상이 있는 경우) 동종이형 조혈모세포이식수술(HSCT)을 받은 환자, 활성 자가면역질환 환자, 면역 억제 치료가 필요한 환자는 모두 제외되었다. 환자들은 허용 불가능한 독성 발생 혹은 질환이 재발하기 전까지 이 약 200 mg을 3주마다 투여했다. PET CT 스캔으로 수정된 림프종 기준으로 반응 여부를 평가했으며 12주차에 첫번째 계획된 기준 시점 이후 스캔을 실시했다. 1차 유효성 평가지표인 객관적 반응률(ORR), 완전관해(CR) 및 반응지속기간(DoR)은 2007년 개정된 IWG 기준에 따른 눈가림된 독립중앙평가(BICR)에 근거하였다. 2차 유효성 평가지표는 무진행생존(PFS) 및 전체생존(OS)이었다.
KEYNOTE ‑087 환자에서 베이스라인 특성은 연령 중앙값(median age) 35세(65세 이상 9%), 남성 54%, 백인 88%, 그리고 ECOG PS 0(45%) 및 1(51%)이었다. 전형적 호지킨 림프종의 치료를 위해 투여된 이전 치료의 중앙값은 4(범위: 1~12)이었다. 81%는 적어도 한 가지 이상의 이전의 치료에 불응성이었고, 이 중 1차 치료에 불응성인 환자 34%가 포함되어있다. 61% 환자가 자가조혈모세포이식수술(auto ‑HSCT) 경험이 있었고, 38%는 이식 부적격자였으며, 17%는 이전에 브렌툭시맙베도틴 치료를 받은 경험이 없었고, 37%의 환자는 이전에 방사선 치료를 받았다.
유효성 결과는 표 51에 요약되어 있다.
표 51. 불응성 또는 재발성의 전형적 호지킨 림프종 환자의 유효성 결과
|
평가 지표 |
3주마다 이 약 200mg n=210 |
|
객관적 반응률(ORR)* |
|
|
객관적 반응률(ORR) % (95% CI) |
71% (64, 77) |
|
완전관해(CR) |
28% |
|
부분관해(PR) |
43% |
|
반응지속기간(DoR)* |
|
|
중앙값(개월) (범위) |
16.6 (0.0+, 39.1+)† |
|
≥12개월 반응지속기간(DoR) % |
59%Þ |
|
무진행생존(PFS)* |
|
|
중앙값(개월) (95% CI) |
13.6 (11.1, 16.7) |
|
전체생존(OS) |
|
|
6개월 전체생존(OS) 비율 |
99.5% |
|
9개월 전체생존(OS) 비율 |
96.1% |
*2007년 개정된 IWG(International Working Group)에 따른 BICR 평가에 근거함
†독립 검토에 응답한 환자(n=149)에 기초함
ÞKaplan ‑Meier 추정 분석에 기초함; 12개월 이상의 반응을 보인 60명의 환자 포함
이 연구는 이 약 200mg을 3주마다 투여시 ORR, CR 및 PR에 대한 임상적으로 유의미한 결과를 보였다.
요로상피암 (Urothelial Carcinoma)
KEYNOTE ‑A39: 요로상피암 환자 대상 엔포투맙베도틴 병용 요법 대조 임상시험
엔포투맙베도틴과 병용한 이 약의 유효성은 백금 기반 항암화학요법이 가능한 국소 진행성 또는 전이성 요로상피암 환자 886명을 대상으로 공개, 다기관, 무작위, 활성 대조군 임상시험인 KEYNOTE ‑A39에서 평가되었다. 이 시험에서 자가면역질환 환자 또는 면역 억제 치료가 필요한 환자, 활성 중추신경계 전이, 지속적인 2급 이상 감각 또는 운동 신경병증, 당뇨병 증상을 동반한 당화혈색소 (HbA1c) ≧7% 또는 HbA1c ≧8%로 정의된 제어되지 않은 당뇨병을 가진 환자들은 제외되었다. 다음 중 하나 이상의 기준을 충족하면 시스플라틴 치료 불가능으로 판단되었다: 사구체 여과율 청소율 30 ‑59 mL/min, ECOG PS ≧2, 2급 이상 청력 손실 또는 NYHA 3급 심부전. 젬시타빈 및 백금 기반 항암화학요법군에 무작위 배정된 환자들은 유지 면역요법을 받을 수 있었다. 무작위 배정은 시스플라틴 치료 가능 여부(가능 또는 불가능), PD ‑L1 발현 [높음(CPS ≧10) 또는 낮음(CPS <10)], 그리고 간 전이 유무로 층화되었다. 환자들은 시험군 또는 대조군에 무작위(1:1) 배정되었으며, 연구에 사용된 약물은 모두 정맥 투여되었다.
◦ 이 약 200 mg를 21일 주기의 1일차에 30분 동안 투여하고, 엔포투맙베도틴을 21일 주기의 1일차와 8일차에 1.25 mg/kg 투여한다.
◦ 젬시타빈을 21일 주기의 1일차와 8일차에 1000 mg/m2 투여하고, 연구자의 선택으로 시스플라틴 70 mg/m2 또는 카보플라틴 (현지 지침에 따라 AUC 4.5 또는 5 mg/mL/min)을 21일 주기의 1일차에 투여한다.
이 약과 엔포투맙베도틴을 병용한 치료는 RECIST v1.1 에 따른 질병의 진행, 허용 불가능한 독성의 발생, 또는 이 약의 경우 최대 35회 (약 2년)까지 진행되었다. 치료는 환자가 치료에 내약성을 보이고 연구자가 임상적 이익이 있다고 판단되는 경우 RECIST 1.1로 정의된 질병 진행 후에도 허용되었다. 종양 상태에 대한 평가는 처음 18개월 동안 매 9주마다, 그 이후에는 매 12주마다 수행되었다. 주요 유효성 평가지표는 눈가림된 독립중앙평가(BICR)에 의해 평가된 RECIST v1.1에 따른 PFS와 OS였다. 추가 유효성 평가지표는 BICR에 의해 평가된 RECIST v1.1에 따른 ORR과 DoR, 통증 진행까지 걸리는 시간 (TTPP)이었다.
연구 모집단 특성은 다음과 같았다: 연령 중앙값 69세, 남성 77%, 백인 67%. 95%가 M1 질병을 가졌으며, 5%는 M0 질병을 가졌다. 73%가 하부 요로에 원발성 종양을 가졌으며, 27%는 상부 요로에 원발성 종양이 있었다. 54%는 시스플라틴 치료 가능했으며, 58%는 PD ‑L1 발현율이 높았고, 72%의 환자가 내장전이가 있었으며 이는 22%의 간 전이를 포함한다. 20%는 정상 신기능 환자였으며, 37%, 41%, 2%는 경증, 중등증, 중증 신장애 환자였다. 97%는 ECOG PS 0 ‑1이었고, 3%는 ECOG PS 2였다. 85%는 이행세포암종(TCC)을 가졌으며, 2%는 기타 조직학을 가진 TCC를 가졌고, 6%는 편평상피분화를 가진 TCC를 가졌다.
이 연구는 이 약과 엔포투맙베도틴 병용 요법을 받은 환자에서 젬시타빈 및 백금 기반 항암화학요법을 받은 환자에 비해 OS, PFS, ORR에 대한 통계적으로 유의미한 개선을 입증했다. 유효성 결과는 모든 사전 지정된 하위군에서 일관되었다.
이 약과 엔포투맙베도틴을 병용한 442명의 환자의 추적 관찰 기간 중앙값은 17.3개월 (범위: 0.3 ‑37.2개월)이었다. 유효성 결과는 표 52, 그림 22 및 그림 23에 요약되어 있다.
표 52. 유효성 결과 (KEYNOTE ‑A39)
|
평가 지표 |
3주마다 이 약 200 mg + 엔포투맙베도틴 n=442 |
젬시타빈 + 백금 기반 항암화학요법 (± 유지 면역요법) n=444 | |
|
전체생존(OS) | |||
|
사건 발생 환자 수 (%) |
133 (30%) |
226 (51%) | |
|
중앙값(개월) (95% CI) |
31.5 (25.4, NR) |
16.1 (13.9, 18.3) | |
|
위험비(HR)* (95% CI) |
0.47 (0.38, 0.58) | ||
|
p-값† |
<0.0001 | ||
|
무진행생존(PFS) | |||
|
사건 발생 환자 수 (%) |
223 (50%) |
307 (69%) | |
|
중앙값(개월) (95% CI) |
12.5 (10.4, 16.6) |
6.3 (6.2, 6.5) | |
|
위험비(HR)* (95% CI) |
0.45 (0.38, 0.54) | ||
|
p-값† |
<0.0001 | ||
|
객관적 반응률(ORR)‡ | |||
|
객관적 반응률(ORR)§ % (95% CI) |
68% (63.1, 72.1) |
44% (39.7, 49.2) | |
|
p-값¶ |
<0.0001 | ||
|
완전반응(CR) |
29% |
12% | |
|
부분반응(PR) |
39% |
32% | |
|
반응지속기간(DoR) | |||
|
중앙값(개월) (범위) |
NR (2.0+, 28.3+) |
7.0 (1.5+, 30.9+) | |
|
≥ 6개월 반응지속기간(DoR)Þ % |
86% |
61% | |
|
≥ 12개월 반응지속기간(DoR)Þ % |
67% |
35% | |
|
≥ 18개월 반응지속기간(DoR)Þ % |
60% |
19% | |
*층화된 Cox 비례 위험 회귀 모형에 기초함
†로그 순위 테스트에 기반한 양측(Two ‑sided) p ‑값
‡치료 여부와 관계없이 측정 가능한 질병을 가진 환자만 포함
§완전반응(CR) 또는 부분반응(PR)을 보인 최상의 객관적 반응 환자를 기준으로 함
¶PD ‑L1 발현율, 시스플라틴 치료 가능 여부 및 간 전이에 의해 층화된 Cochran ‑Mantel ‑Haenszel 테스트에 기반한 양측(Two ‑sided) p ‑값
ÞKaplan ‑Meier 추정 분석에 기초함
NR = 도달하지 않음
그림 22. KEYNOTE ‑A39의 전체생존(OS) Kaplan ‑Meier 곡선

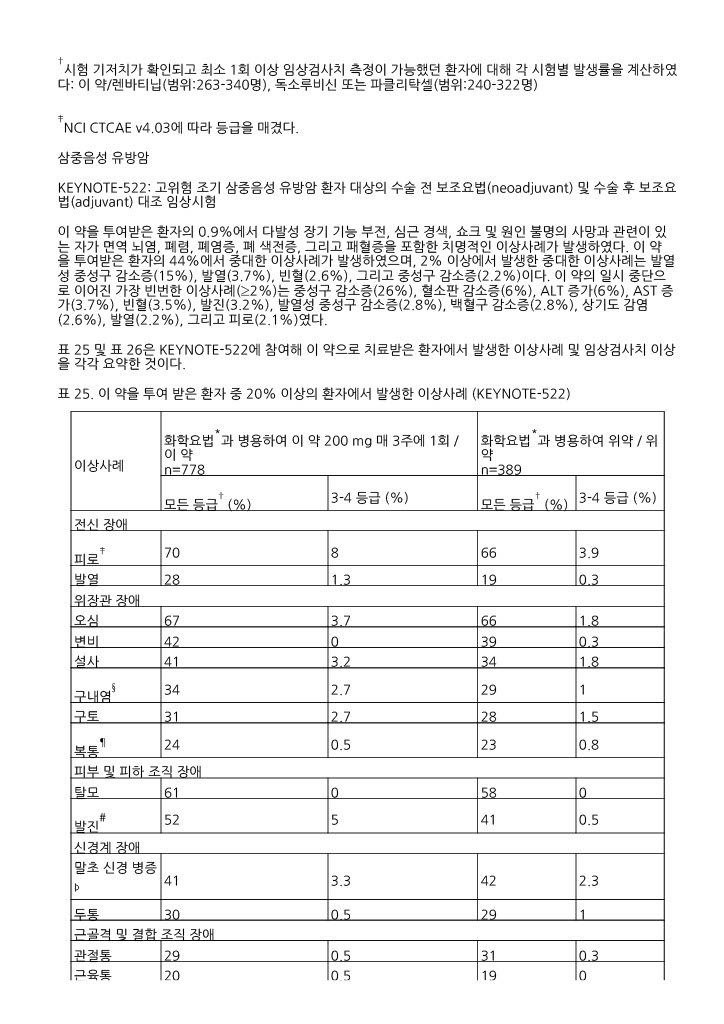
이 약의 유효성은 백금 기반 항암화학요법이 불가능한 환자를 포함하여 하나 이상의 동반질환을 지닌 국소 진행성 또는 전이성 요로상피암 환자 370명을 대상으로 다기관, 공개 임상, 단일군 임상시험인 KEYNOTE ‑052에서 평가되었다. 이 시험에서 자가면역질환 환자 또는 면역 억제 치료가 필요한 환자는 제외되었다. 환자들은 허용 불가능한 독성 발생이나 질병 진행 전까지 이 약 200 mg을 3주마다 투여 받았다. 초기 방사선학적으로 질병 진행을 보인 환자들은 질병 진행의 증상이 있거나, 빠른 진행이거나, 신속한 개입이 필요한 경우이거나, 활동 상태가 저하된 상태에서 발생하지 않은 한 질병 진행 중에도 추가 투약을 받을 수 있었다. 질병 진행이 없는 환자의 경우 최대 24개월까지 치료받을 수 있었다. 종양 반응 평가는 1차 투여 9주 후, 그 후 첫 해에는 6주마다, 그 후 12주마다 수행되었다. 주요 유효성 결과 측정값은 RECIST 1.1에 따른 눈가림된 독립중앙평가(BICR)에 의해 평가된 객관적 반응률(ORR) 및 반응지속기간(DoR)이었으며, 최대 10개의 표적 병변과 장기당 최대 5개의 표적 병변을 따르도록 수정되었다.
환자의 베이스라인 특성은 다음과 같다. 연령 중앙값(median age) 74세, 남성 77%, 그리고 백인 89%이었다. 87%는 M1, 13%는 M0 상태였다. 81%는 하부 요로에 원발성 종양을 가졌으며, 19%는 상부 요로에 원발성 종양이 있었다. 85%는 내장전이가 있었으며, 이는 21%의 간 전이를 포함한다. 50%는 기저 크레아티닌 클리어런스가 60 미만 mL/min이었고, 32%는 ECOG PS가 2, 9%는 ECOG PS가 2이면서 기저 크레아티닌 클리어런스가 60 미만 mL/min이었으며, 9%는 3급 심장 부전, 2급 이상 말초신경병증, 2급 이상 청력 소실 중 하나 이상에 해당되었다. 90%의 환자는 치료 경험이 없었으며, 10%는 이전에 수술 후 보조요법(adjuvant) 또는 수술 전 보조요법(neoadjuvant)으로 백금 기반 화학요법을 받았다.
이 약으로 치료받은 환자 370명의 추적 관찰 기간은 중앙값은 11.4개월(범위 0.1 ‑63.8개월)이었다. 유효성 결과는 표 53에 요약되어 있다.
표 53. 유효성 결과 (KEYNOTE ‑052)
|
평가 지표 |
3주마다 이 약 200 mg |
|
모든 환자군 n=370 | |
|
객관적 반응률(ORR) |
|
|
객관적 반응률(ORR) (95% CI) |
29% (24, 34) |
|
완전 반응(CR) |
10% |
|
부분 반응(PR) |
20% |
|
반응지속기간(DoR) |
|
|
중앙값(개월) (범위) |
33.4 (1.4+, 60.7+) |
+ 진행중임을 나타냄
이전에 치료 경험이 없는 백금 기반 항암화학요법 가능 환자
이 약의 유효성은 이전에 치료 경험이 없는 백금 기반 항암화학요법이 가능한 1010명의 국소 진행성 또는 전이성 요로상피암 환자 대상에서의 1차 치료로써 다기관, 무작위 배정, 공개 임상, 활성 대조군 임상시험인 KEYNOTE ‑361에서 평가되었다. 이전에 치료 경험이 없는 국소 진행성 또는 전이성 요로상피암 환자에서 백금 기반 항암화학요법 병용에 대한 이 약의 안전성 및 유효성은 확립되지 않았다.
이 시험은 이 약을 백금 기반 항암화학요법(즉, 젬시타빈과 시스플라틴 또는 카보플라틴)과 병용하거나 병용하지 않은 단독요법으로서 백금 기반 항암화학요법과 비교하였다. 이 약과 백금 기반 항암화학요법을 병용한 환자 중 44%는 시스플라틴, 56%는 카보플라틴을 투여하였다.
이 시험은 이 약과 항암화학요법 병용 군에서 항암화학요법 단독 군 대비 주요 유효성 평가지표인 PFS 또는 OS 의 개선을 충족하지 못 하였다. 추가 유효성 평가지표는, 이 약 단독요법의 OS 개선을 포함하여 공식적으로 검증되지 않았다.
KEYNOTE ‑045: 이전에 백금 기반 화학요법제 치료를 받은 요로상피암 환자 대상의 대조 임상시험
이 약의 유효성은 백금 기반 화학요법제 치료 도중 또는 이후에 질병 진행이 확인된 국소 진행성 또는 전이성 요로상피암 환자를 대상으로 다기관, 무작위 배정(1:1), 활성 대조군(active ‑control) 임상시험인 KEYNOTE ‑045에서 평가되었다. 자가면역질환 환자, 면역 억제를 필요로 하는 환자는 이 시험에서 제외되었다.
환자들은 3주마다 이 약 200 mg를 정맥으로 투여(n=270) 또는 연구자가 선택한 다음 화학요법 중 하나를 3주마다 정맥으로 투여(n=272) 받았다.
▪ 파클리탁셀 175 mg/m2(n=84), 도세탁셀 75 mg/m2(n=84), 또는 빈플루닌 320 mg/m2(n=87).
허용 불가능한 독성이나 질병 진행이 확인되기 전까지 환자들은 이 약 치료를 받았다. 질병 진행의 초기 증상을 보였으나 임상적으로 안정된 환자들은 질병 진행이 확인될 때까지 치료를 유지하도록 허용되었다. 질병 진행이 없는 환자의 경우 최대 24개월까지 치료받을 수 있었다. 후속 질병 진행 시 이 약을 사용한 치료를 재개하고 최대 1년까지 추가 투여할 수 있었다. 종양 상태 평가는 무작위 배정 9주 후, 그 후 첫 해에는 6주마다, 그 후 12주마다 수행되었다. 1차 유효성 평가지표는 RECIST 1.1에 따른 눈가림된 독립중앙평가(BICR)에 근거한 전체생존(OS) 및 무진행생존(PFS)였다. 2차 유효성 평가지표는 RECIST 1.1에 따른 눈가림된 독립중앙평가(BICR)에 근거한 객관적 반응률(ORR) 및 반응지속기간(DoR)이었다.
무작위 배정된 542명의 환자들 중, 시험 참여군의 특성은 다음과 같다. 연령 중앙값 66세(범위: 26~88세), 65세 이상 58%, 남성 74%, 백인 72%, 그리고 동양인 23%이었다. 57%는 ECOG PS가 1 이상이며; M1 96%, M0 4%이다. 87%는 내장전이가 있었으며, 이 중 34%의 간 전이를 포함한다. 86%는 하부 요로에 원발성 종양을 가졌으며, 14%는 상부 요로에 원발성 종양이 있었다. 환자의 15%는 가장 최근 치료로 수술 후 보조요법(adjuvant) 또는 수술 전 보조요법(neoadjuvant)으로 백금 기반 화학요법을 받은 후 질병 진행이 있었다. 21%는 이전에 전이상태에서 2가지 이상의 전신 치료를 받은 적이 있다. 76%는 이전에 시스플라틴 치료를 받았으며, 23%는 카보플라틴, 그리고 1%는 다른 백금 기반 화학요법을 받았다.
유효성 결과는 표 54에 요약되어 있다.
표 54. 이전에 화학요법치료제 치료를 받은 요로상피암 환자의 유효성 결과
|
평가 지표 |
3주마다 이 약 200 mg n=270 |
화학요법 n=272 |
|
전체생존(OS)* | ||
|
사건 발생 환자 수 (%) |
200 (74%) |
219 (81%) |
|
중앙값(개월) (95% CI) |
10.1 (8.0, 12.3) |
7.3 (6.1, 8.1) |
|
위험비(HR)†(95% CI) |
0.70 (0.57, 0.85) | |
|
p-값‡ |
<0.001 | |
|
무진행생존(PFS)§ | ||
|
사건 발생 환자 수 (%) |
218 (81%) |
219 (81%) |
|
중앙값(개월) (95% CI) |
2.1 (2.0, 2.2) |
3.3 (2.3, 3.5) |
|
위험비(HR)†(95% CI) |
0.98 (0.81, 1.19) | |
|
p-값‡ |
0.416 | |
|
객관적 반응률(ORR)§ | ||
|
객관적 반응률(ORR) % (95% CI) |
21% (16, 27) |
11% (8, 16) |
|
p-값¶ |
0.001 | |
|
반응지속기간(DoR)§,# | ||
|
중앙값(개월) (범위) |
도달하지 않음 (1.6+, 15.6+) |
4.3 (1.4+, 15.4+) |
*최종 분석에 기초함
†층화된 Cox 비례 위험 모형에 기초한 위험비(HR)(화학요법 대비 이 약)
‡층화된 로그 순위 테스트(log ‑rank test)에 기초함
§RECIST 1.1에 따른 BICR 평가에 근거함
¶Miettinen & Nurminen 방법에 기초함
#완전반응(CR) 또는 부분반응(PR)을 보인 최상의 객관적 반응 환자를 기준으로 함
이 연구는 이 약 200mg을 3주마다 투여시 화학요법 대비 OS 및 ORR에 대한 통계적으로 유의미한 개선을 입증하였다.
그림 24. KEYNOTE ‑045 치료군의 전체생존(OS) Kaplan ‑Meier 곡선 (ITT 집단)
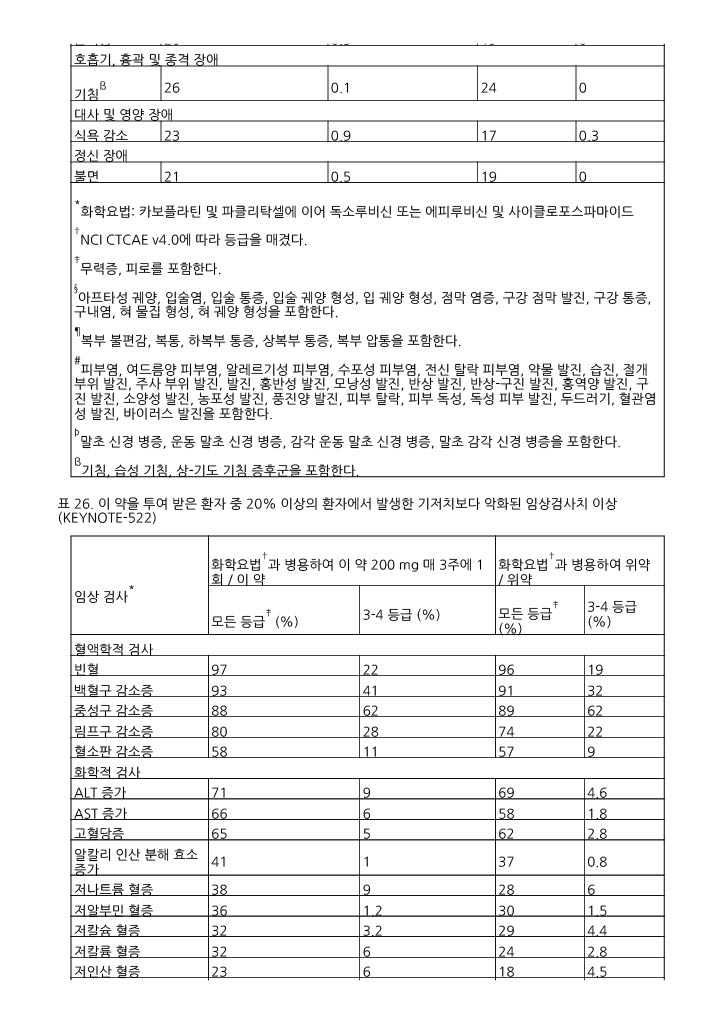
이 약의 유효성은 방광 절제술이 불가능하거나 시행을 선택하지 않았으며, 유두종 유무에 상관없이 상피내암을 동반한 BCG ‑불응 고위험 비근침습성 방광암(NMIBC) 환자 96명을 대상으로 다기관, 공개 임상, 단일군 임상시험인 KEYNOTE ‑057에서 평가되었다. BCG ‑불응 고위험 NMIBC는 적절한 BCG 치료 후에도 지속성인 질병, 적절한 BCG 치료를 통해 종양이 없는 상태 후 질병 재발, 또는 BCG의 단일 유도 과정 후 T1 질환이 발생한 경우로 정의되었다. 치료 전 모든 환자들은 적절한 BCG 치료를 받았으며, 모든 절제 가능한 병변(Ta 및 T1 성분)을 제거하고 근침습성 질환의 부재를 보장하기 위해 방광경 검사 및 경요도방광암절제술(TURBT)을 받았다. 완전한 절제가 불가능한 잔여 CIS(Tis 성분)는 허용되었다. 이 시험에서 근침습성(예: T2, T3, T4)이 국소적으로 진행된 절제 불가능한 또는 전이성 요로상피세포암, 방광외막(예: 요도, 요관 또는 신우) 비근침습성 이행 요로상피세포암, 자가면역질환 환자 또는 면역 억제 치료가 필요한 환자는 제외되었다.
환자들은 허용 불가능한 독성이나, 지속성 또는 재발성 고위험 NMIBC, 또는 진행 병변이 확인되기 전까지 이 약 200 mg을 3주마다 투여 받았다. 종양 상태에 대한 평가는 12주마다 진행되며, 질병 진행이 없는 환자의 경우 최대 24개월까지 치료받을 수 있었다. 1차 유효성 평가지표는 방광경 검사에 대한 음성 결과[해당되는 경우 TURBT/biopsies 포함], 요세포검사, 전산화 단층촬영 요로 조영술[CTU]로 정의한 완전반응(CR)과 반응지속기간(DoR)이었다.
시험 참가자 특성은 다음과 같다. 연령 중앙값(median age) 73세(65세 이상 69%), 남성 84%, 백인 67%, 그리고 ECOG 결과가 0 또는 1이 각각 73%와 27%였다. 연구 초기의 종양 패턴은 T1 CIS (13%), TA 등급이 높은 CIS(25%), 및 CIS(63%)였다. 기준선 고위험 NMIBC 질환 상태는 27%가 지속성이고 73%가 재발성이었다. BCG의 이전 주입 횟수의 중앙값은 12회였다.
추적 관찰 기간의 중앙값은 28개월(범위: 4.6~40.5개월)이었다. 유효성 결과는 표 55에 요약되어 있다.
표 55. BCG ‑불응 고위험 NMIBC 환자의 유효성 결과
|
평가 지표 |
3주마다 이 약 200mg n=96 |
|
완전반응(CR) 비율* |
41% |
|
반응지속기간(DoR)† |
|
|
중앙값(개월) (범위) |
16.2 (0.0+, 30.4+) |
|
≥12개월 반응지속기간(DoR)의 환자 % |
57%‡ |
|
*방광경 검사에 대한 음성 결과(해당되는 경우 TURBT/biopsies 포함), 요세포검사, 전산화 단층촬영 요로 조영술(CTU)에 기초함 †지속 기간은 완전반응(CR)이 달성된 기간을 반영함 ‡Kaplan-Meier 추정 분석에 기초함; 12개월 이상의 반응을 보인 18명의 환자 포함 | |
이 연구는 이 약 200mg을 3주마다 투여시 CR 및 DoR에 대한 임상적으로 유의미한 결과를 보였다.
위암(Gastric Cancer)
KEYNOTE ‑811: 수술이 불가능한 국소 진행성 또는 전이성 HER2 양성 위 또는 위식도접합부 선암의 1차 치료
이 약과 트라스투주맙과 플루오로피리미딘 및 백금 화학요법제 병용 요법의 유효성은 PD ‑L1 발현 여부와 관계없이, 이전에 전이성 질환에 대한 전신치료 경험이 없는 HER2 양성 진행성 위 또는 위식도접합부 선암 환자 698명이 등록된 다기관, 무작위, 이중 맹검, 위약 대조군 임상시험인 KEYNOTE ‑811에서 평가되었다. 이 임상시험에서는 2년 이내 전신 치료가 필요했던 자가면역질환 환자 또는 면역 억제를 필요로 하는 의학적 상태를 가진 환자는 제외했다. 무작위배정은 PD ‑L1 발현여부(CPS ≧1 또는 <1), 항암화학요법(5 ‑FU 및 시스플라틴[FP] 또는 카페시타빈 및 옥살리플라틴[CAPOX]), 그리고 지리적 영역(유럽/ 이스라엘/ 북미/ 호주, 아시아 또는 기타 국가들)에 의해 층화되었다. 환자들은 다음 치료군 중 하나에 무작위 배정(1:1)되었다; 경구 카페시타빈을 제외한 모든 치료 약물은 매 3주마다 정맥 점적주입되었다:
◦이 약 200mg, 트라스투주맙 첫 주입으로 8mg/kg과 후속 주기에는 6mg/kg 투약하며, 이어서 화학요법은 연구진의 선택으로 시스플라틴 80mg/m2 최대 6주기 및 5 ‑FU 800mg/m2/day 5일간 병용(FP) 또는 옥살리플라틴 130mg/m2 최대 6 ‑8주기 및 카페시타빈 1000mg/m2 14일간 1일 2회 병용(CAPOX) 하였다. 이 약은 매 주기 첫날 트라스투주맙 및 항암화학요법 투여 이전에 투여되었다.
◦ 위약, 트라스투주맙 첫 주입으로 8mg/kg과 후속 주기에는 6mg/kg 투약하며, 이어서 화학요법은 연구진의 선택으로 시스플라틴 80mg/m2 최대 6주기 및 5 ‑FU 800mg/m2/day 5일간 병용(FP) 또는 옥살리플라틴 130mg/m2 최대 6 ‑8주기 및 카페시타빈 1000mg/m2 14일간 1일 2회 병용(CAPOX) 하였다. 위약은 매 주기 첫날 트라스투주맙 및 항암화학요법 투여 이전에 투여되었다.
이 약과 트라스투주맙 및 항암화학요법의 병용 요법 또는 위약과 트라스투주맙 및 항암화학요법의 병용 요법은 RECIST v1.1에 따른 BICR 평가에 근거한 질병의 진행이 확인되기 전, 허용 불가능한 독성 발생 전, 또는 최대 24개월까지 계속 진행되었다. 종양 상태에 대한 평가는 6주마다 수행되었다.
KEYNOTE ‑811 연구에서 무작위 배정된 698명의 환자 중, 594명(85%)은 PD ‑L1 IHC 22C3 pharmDx™ 키트를 사용하여 PD ‑L1 종양 발현이 CPS ≧1로 나타났다. 이 594명의 인구학적 특성은: 연령 중앙값(median age) 63세(범위: 19 ‑85), 65세 이상 43%, 남성 80%, 백인 63%, 동양인 33%, 흑인 0.7%, ECOG PS 0 42%, 그리고 ECOG PS 1 58%였다. 98%의 환자는 전이성 질환(stage Ⅳ)이었고, 2%는 절제 불가능한 국소 진행성 질환이었다. 95%(n=562)의 환자는 MSI ‑H가 아니었으며, 1%(n=8)의 환자는 MSI ‑H였고, 4%(n=24)의 환자는 정보가 확인되지 않았다. 85%의 환자가 CAPOX 항암화학요법을 받았다.
일차 평가변수는 RECIST v1.1에 따른 BICR 평가에 근거한 무진행 생존(PFS)과 전체생존(OS)이었다. 이차 평가변수는 RECIST v1.1에 따른 BICR 평가에 근거한 객관적반응률(ORR)과 반응지속기간(DoR) 이었다.
1차 중간 분석은 전체 무작위 배정 집단 중 264명의 환자를 대상으로 진행되었고(이 약군 133명과 위약군 131명), 객관적반응률에 대한 통계적으로 유의한 개선이 확인되었다(74.4% vs. 51.9%, 22.7% 차이; 95% CI(11.2, 33.7), p ‑값 0.00006).
2차 중간 분석은 전체 환자군을 대상으로 진행되었고, 이 약과 트라스투주맙 및 항암화학요법의 병용 요법군에서 위약과 트라스투주맙 및 항암화학요법 병용 요법군 대비 통계적으로 유의한 PFS의 개선을 입증하였다(HR 0.72, 95% CI 0.60, 0.87, p ‑값 0.0002). 전체 환자군을 대상으로 진행한 이번 분석 시점에서는 전체 생존에 대한 통계적인 유의성은 확인되지 않았다.
사전 지정된 PD ‑L1 발현이 CPS ≧1 이상인 환자군에 대한 2차 중간분석 결과는 표 56, 그림 25 및 그림 26에 요약되어 있다.
표 56. PD ‑L1 발현이 CPS ≧1 이상인 환자군에 대한 유효성 결과
|
평가 지표 |
이 약 200mg 매 3주에 1회
트라스투주맙 플루오로피리미딘 및 백금화학요법 n=298 |
위약
트라스투주맙 플루오로피리미딘 및 백금화학요법 n=296 |
|
무진행생존(PFS) | ||
|
사건 발생 환자 수 (%) |
199 (67%) |
215 (73%) |
|
중앙값(개월) (95% CI) |
10.8 (8.5, 12.5) |
7.2 (6.8, 8.4) |
|
위험비(HR)* (95% CI) |
0.70 (0.58, 0.85) | |
|
p-값† |
0.0001 | |
|
전체생존(OS) | ||
|
사건 발생 환자 수 (%) |
167 (56%) |
183 (62%) |
|
중앙값(개월) (95% CI) |
20.5 (18.2, 24.3) |
15.6 (13.5, 18.6) |
|
위험비(HR)* (95% CI) |
0.79 (0.64, 0.98) | |
|
p-값† |
0.0143 | |
|
객관적 반응률(ORR) | ||
|
객관적 반응률‡ (95% CI) |
73% (67.7, 78.1) |
58% (52.6, 64.1) |
|
완전 반응률 |
14% |
10% |
|
부분 반응률 |
59% |
49% |
|
차이§ (95% CI) |
15% (7, 22) | |
|
p-값§ |
0.00008 | |
|
반응지속기간 |
n=218 |
n=173 |
|
중앙값(개월) (범위) |
11.3 (1.1+, 40.1+) |
9.5 (1.4+, 38.3+) |
|
≥6개월 반응지속기간(DoR) %¶ |
75% |
67% |
|
≥12개월 반응지속기간(DoR) %¶ |
49% |
41% |
* 층화되지않은 Cox 비례 위험 모형에 기초함
† 층화되지않은 로그 순위 테스트(log ‑rank test)에 기초함; p ‑값은 명목적 p ‑값임
‡ 반응: 완전 반응 또는 부분 반응으로 확인된 최상의 객관적 반응
§ 층화되지않은 Miettinen & Nurminen 방법에 기초함; p ‑값은 명목적 p ‑값임
¶ Kaplan ‑Meier estimation에 기초함
그림25. KEYNOTE ‑811에서 PD ‑L1 발현 양성(CPS ≧1)인 치료군의 무진행생존(PFS) Kaplan ‑Meier 곡선
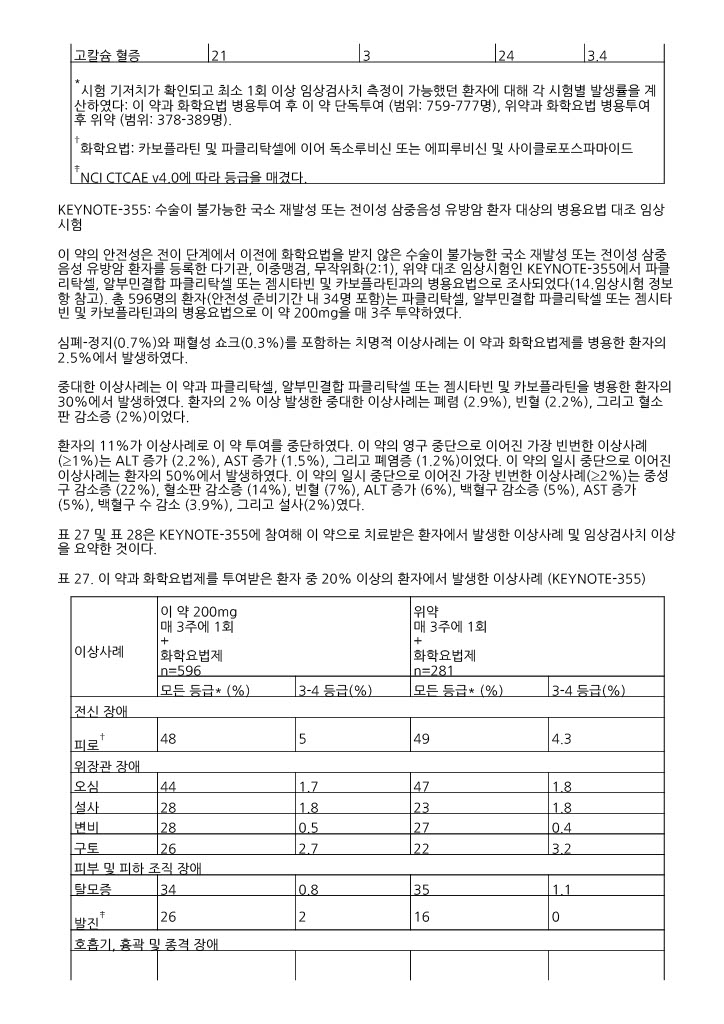
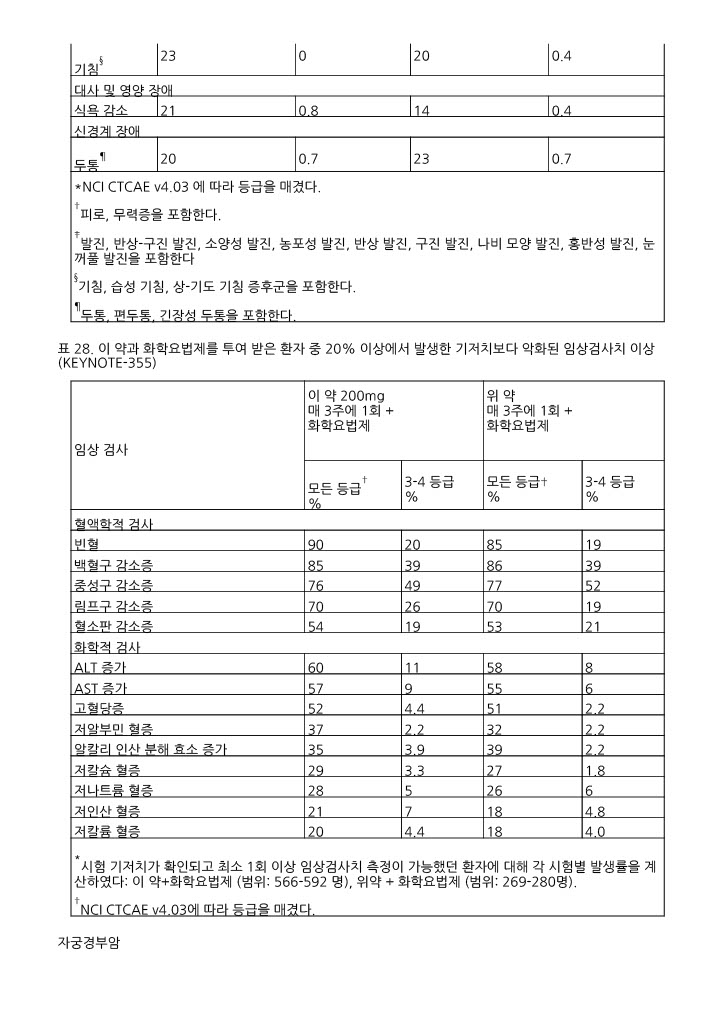
이 약과 플루오로피리미딘 및 백금 화학요법과의 병용요법의 유효성은 PD ‑L1 발현여부와 관계 없이 이전에 전이성 질환에 대한 전신 치료를 받은 경험이 없는 HER2 음성 진행성 위 또는 위식도접합부 선암 환자 1579명을 대상으로 다기관, 무작위 배정, 이중 맹검, 위약 대조 임상시험인 KEYNOTE ‑859에서 평가되었다.
2년 이내 전신 치료가 필요했던 자가면역질환 환자 또는 면역 억제를 필요로 하는 의학적 상태를 가진 환자는 제외되었다. 무작위화는 PD ‑L1 발현여부(CPS ≧1 또는 <1), 화학요법(5 ‑FU 및 시스플라틴[FP] 또는 카페시타빈 및 옥살리플라틴[CAPOX]), 그리고 지리적 영역(유럽/ 이스라엘/ 북미/ 호주, 아시아 또는 기타 국가들)으로 층화되었다. 환자들은 다음 치료군 중 하나에 무작위 배정(1:1)되었다; 경구 카페시타빈을 제외한 모든 치료 약물은 매 3주마다 정맥 점적주입되었다:
◦ 이 약 200mg, 연구진의 선택으로 시스플라틴 80mg/m2 및 5 ‑FU 1일 800mg/m2 5일 투여[FP] 또는 옥살리플라틴 130mg/m2 및 카페시타빈 1000mg/m2 1일 2회 14일 투여[CAPOX]를 최대 35주기 동안 투여. 이 약은 매 주기 첫날 화학요법 투여 이전에 투여되었다.
◦ 위약, 연구진의 선택으로 시스플라틴 80mg/m2 및 5 ‑FU 1일 800mg/m2 5일 투여[FP] 또는 옥살리플라틴 130mg/m2 및 카페시타빈 1000mg/m2 1일 2회 14일 투여[CAPOX]를 최대 35주기 동안 투여. 위약은 매 주기 첫날 화학요법 투여 이전에 투여되었다.
이 약과 화학요법의 병용 요법 또는 위약과 화학요법의 병용 요법은 RECIST v1.1에 따른 BICR 평가에 근거한 질병의 진행이 확인되기 전, 허용 불가능한 독성 발생 전, 또는 최대 24개월까지 계속 진행되었다. 치료는 환자가 임상적으로 안정적이고 연구자에 의해 임상적 이익을 도출하는 것으로 간주되는 경우 RECIST가 정의한 질병 진행 후에도 허용되었다. 종양 상태에 대한 평가는 6주마다 수행되었다. 일차 평가변수는 전체생존(OS)였다. 추가적인 이차 평가변수는 RECIST v1.1에 따른 BICR 평가에 근거한 무진행 생존(PFS), 객관적반응률(ORR) 및 반응지속기간(DoR) 이었다.
인구학적 특성은: 연령 중앙값(median age) 62세(범위: 21 ‑86), 65세 이상 39%, 남성 68%, 백인 55%, 동양인 34%, ECOG PS 0 37%, 그리고 ECOG PS 1 63%였다. 97%의 환자는 전이성 질환(stage Ⅳ)이었고, 3%는 절제 불가능한 국소 진행성 질환이었다. 78%는 PD ‑L1 발현 CPS ≧1인 종양을 가졌고, 5%(n=74)의 환자는 MSI ‑H 인 종양을 가졌다. 86%의 환자가 CAPOX 항암화학요법을 받았다.
이 약과 화학요법 병용 요법에 배정된 환자군에서 위약과 화학요법 병용 요법에 비해 통계적으로 유의한 OS, PFS 및 ORR의 개선이 입증되었다. 유효성 결과는 표 57에 요약되어 있다.
표 57. KEYNOTE ‑859의 유효성 결과
|
평가지표 |
이 약 200mg 3주마다
FP 또는 CAPOX n=790 |
위약
FP 또는 CAPOX n=789 |
|
전체생존(OS) | ||
|
사건 발생 환자 수(%) |
603 (76) |
666 (84) |
|
중앙값(개월)* (95% CI) |
12.9 (11.9, 14.0) |
11.5 (10.6, 12.1) |
|
위험비(HR)†(95% CI) |
0.78 (0.70, 0.87) | |
|
p-값‡ |
<0.0001 | |
|
무진행생존(PFS) | ||
|
사건 발생 환자 수(%) |
572 (72) |
608 (77) |
|
중앙값(개월)* (95% CI) |
6.9 (6.3, 7.2) |
5.6 (5.5, 5.7) |
|
위험비(HR)† (95% CI) |
0.76 (0.67, 0.85) | |
|
p-값‡ |
<0.0001 | |
|
객관적 반응률(ORR) | ||
|
객관적 반응률§(95% CI) |
51% (47.7, 54.8) |
42% (38.5, 45.5) |
|
완전 반응률 |
9% |
6% |
|
부분 반응률 |
42% |
36% |
|
차이 (95% CI) |
9% (4.4, 14.1) | |
|
p-값¶ |
0.00009 | |
|
반응지속기간 |
n=405 |
n=331 |
|
중앙값(개월) (범위) |
8.0 (1.2+, 41.5+) |
5.7 (1.3+, 34.7+) |
|
≥12개월 반응지속기간(DoR) %* |
39% |
26% |
|
≥24개월 반응지속기간(DoR) %* |
27% |
13% |
* Kaplan ‑Meier 추정 분석에 기초함
† 층화된 Cox 비례 위험 모형에 기초함
‡ 층화된 로그 순위 테스트(log ‑rank test)에 기초한 단측(one ‑sided) p ‑값
§ 완전 반응(CR) 또는 부분 반응(PR)으로 확인된 최상의 객관적 반응
¶ 층화된 Miettinen & Nurminen 방법에 기초한 단측(one ‑sided) p ‑값
그림27. KEYNOTE ‑859에서 치료군의 전체생존(OS) Kaplan ‑Meier 곡선
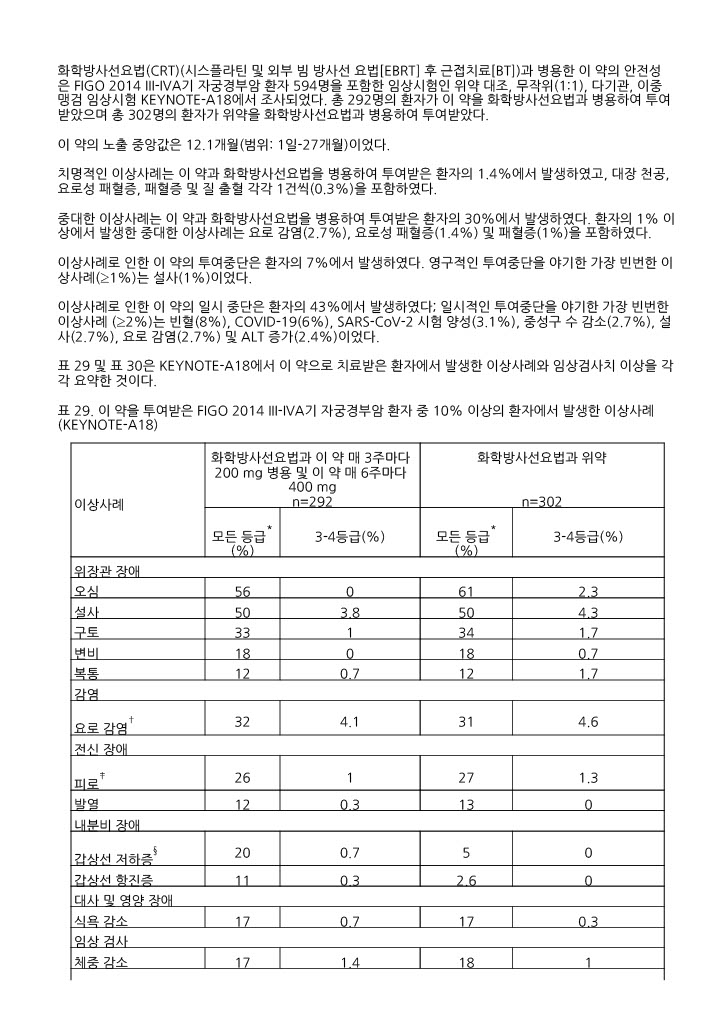
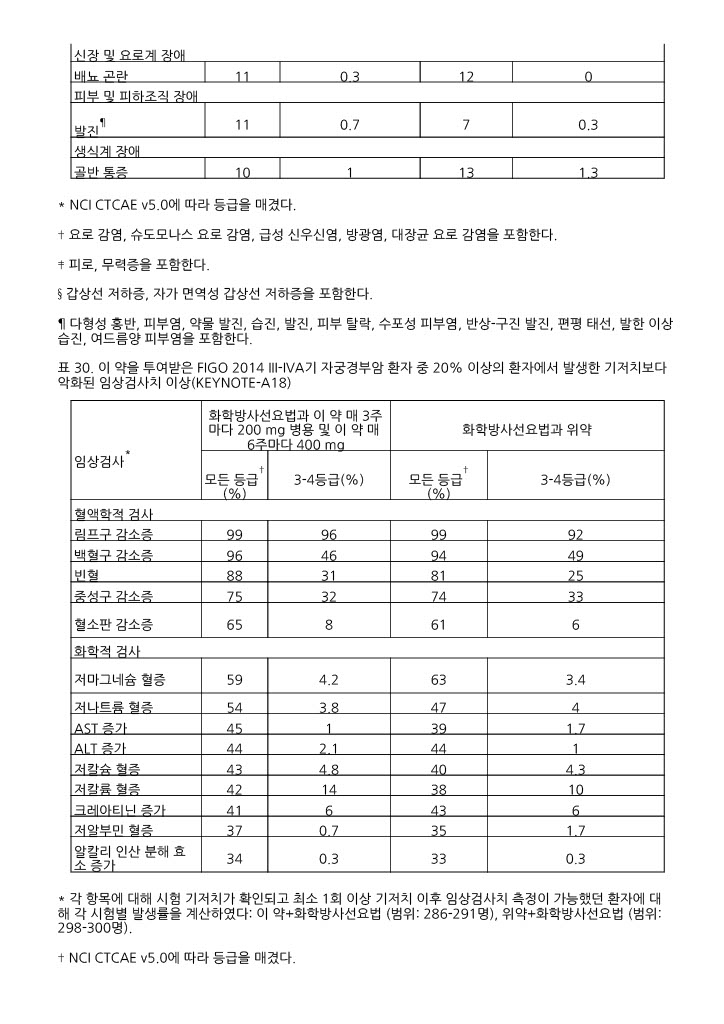
KEYNOTE ‑590: 수술이 불가능한 국소 진행성 또는 전이성 식도암/위식도 접합부암의 1차 치료
이 약의 유효성은 수술이 불가능한 국소 진행성 또는 전이성 식도암 및 위식도 접합부암(Siewert type I)의 1차 치료로써, 환자 749명을 대상으로 다기관, 무작위 배정, 위약 대조 임상시험인 KEYNOTE ‑590에서 평가되었다. 중앙 실험실에서 PD ‑L1 검사를 위한 모든 환자의 종양 표본이 필요했고, PD ‑L1 IHC 22C3 pharmDx™ 키트를 사용하여 종양 PD ‑L1 발현을 결정했다. 활성 자가면역질환 또는 면역 억제를 필요로 하는 의학적 상태를 가진 환자, 또는 HER ‑2 양성 위식도 접합부(GEJ) 선암종 환자는 제외되었다. 무작위화는 종양 조직학(편평 세포 암종 vs. 선암종), 지리적 영역(아시아 vs. 아시아 외) 및 ECOG PS(0 vs. 1)에 의해 층화되었다.
환자는 시험군 또는 대조군에 무작위 배정(1:1)되었고, 모든 시험 약물은 정맥 점적주입되었다.
▪ 이 약 200mg 또는 위약을 매 3주 1일차에 투여하며, 시스플라틴 80 mg/m2매 3주 1일차에 6사이클까지 그리고 5 ‑FU 800 mg/m2매 3주 1일차부터 5일차까지 투여하거나, 지역 표준 치료법에 따라 병용 투여했다.
이 약 또는 화학요법은 허용 불가능한 독성 발생 전이나 질병의 진행이 확인되기 전까지 계속 진행되었다. 이 약에 무작위 배정된 환자는 최소 4주 이후 반복 영상으로 질병 진행의 방사선 근거가 처음 확인될 때까지 임상적으로 안정한 경우 처음 RECIST v1.1가 정의한 질병 진행 후에도 허용되었다. 질병 진행이 없는 환자의 경우 최대 24개월까지 치료받을 수 있었다. 종양 상태에 대한 평가는 9주마다 수행되었다. 1차 유효성 평가지표는 조직학적 편평 세포, CPS ≧10 및 전체 환자군에서 RECIST 1.1에 따라 연구자가 평가한 OS와 PFS이었다. 이 연구는 사전에 지정된 모든 시험군에 대해 OS 및 PFS에서 통계적으로 유의미한 개선을 보였다. 2차 유효성 평가지표는 RECIST 1.1에 근거하여 연구자가 평가한 ORR 및 DoR이었다.
KEYNOTE ‑590에서 749명의 환자 중 383명(51%)이 PD ‑L1 발현 CPS ≧10인 종양을 가졌다. 이러한 383명의 시험 참가자의 특성은 다음과 같다: 연령 중앙값 63세(범위: 28 ‑89세), 65세 이상 41%; 남성 82%; 백인 34% 그리고 아시아인 56%; ECOG PS 0 43% 그리고 ECOG PS 1 57%. 93%는 M1 질병을 가졌으며, 7%는 M0 질병을 가졌다. 종양 조직학적으로 75%는 편평 세포 암종을 가졌고, 25%는 선암종을 가졌다.
KEYNOTE ‑590에서 PD ‑L1 발현 CPS ≧10인 종양을 가진 환자에서의 주요 유효성 결과는 사전 지정된 분석으로 표 58에 요약되어 있다. OS 및 PFS의 Kaplan ‑Meier 곡선은 그림 29 및 그림 30에 나타내고 있다.
표 58. PD ‑L1 발현(CPS ≧10)에서 이 약 + 화학요법제의 유효성 결과(KEYNOTE ‑590)
|
평가 지표 |
이 약 200 mg 3주마다 시스플라틴 5-FU n=186 |
위약 시스플라틴 5-FU n=197 |
|
전체 생존(OS) | ||
|
사건 발생 환자 수 (%) |
124 (66.7%) |
165 (83.8%) |
|
중앙값(개월)* (95% CI) |
13.5 (11.1, 15.6) |
9.4 (8.0, 10.7) |
|
위험비(HR)†(95% CI) |
0.62 (0.49, 0.78) | |
|
p -값(층화된 로그 순위)§ |
<0.0001 | |
|
무진행 생존(PFS)‡ | ||
|
사건 발생 환자 수 (%) |
140 (75.3%) |
174 (88.3%) |
|
중앙값(개월)* (95% CI) |
7.5 (6.2, 8.2) |
5.5 (4.3, 6.0) |
|
위험비(HR)†(95% CI) |
0.51 (0.41, 0.65) | |
|
p-값 (층화된 로그 순위)§ |
<0.0001 | |
|
객관적 반응률(ORR)‡ | ||
|
객관적 반응률(ORR)§(95% CI) |
51.1 (43.7, 58.5) |
26.9 (20.8, 33.7) |
|
p-값¶ |
< 0.0001 | |
|
반응지속기간(DoR)‡,# | ||
|
반응지속기간(DoR) 중앙값(개월) (범위) |
10.4 (1.9, 28.9+) |
5.6 (1.5+, 25.0+) |
|
*Kaplan-Meier 추정 분석에 기초함 †층화된 Cox 비례 위험 모형에 기초함 ‡RECIST 1.1에 따른 연구자의 평가에 근거함 §지리적 영역(아시아 vs. 기타 국가들), 종양 조직학(선암종 vs. 편평 세포 암종) 및 ECOG PS(0 vs. 1)에 따라 층화된 로그 순위 테스트(log-rank test)에 기초한 단측(one-sided) p-값 ¶검정을 위한 단측(one-sided) p-값. H0: %의 차이=0 vs. H1 : %의 차이>0 #완전반응(CR) 또는 부분반응(PR)으로 확인된 최상의 객관적 반응 | ||
그림 29. KEYNOTE ‑590에서 PD ‑L1 발현 양성(CPS ≧10)인 치료군의 전체 생존(OS) Kaplan ‑Meier 곡선
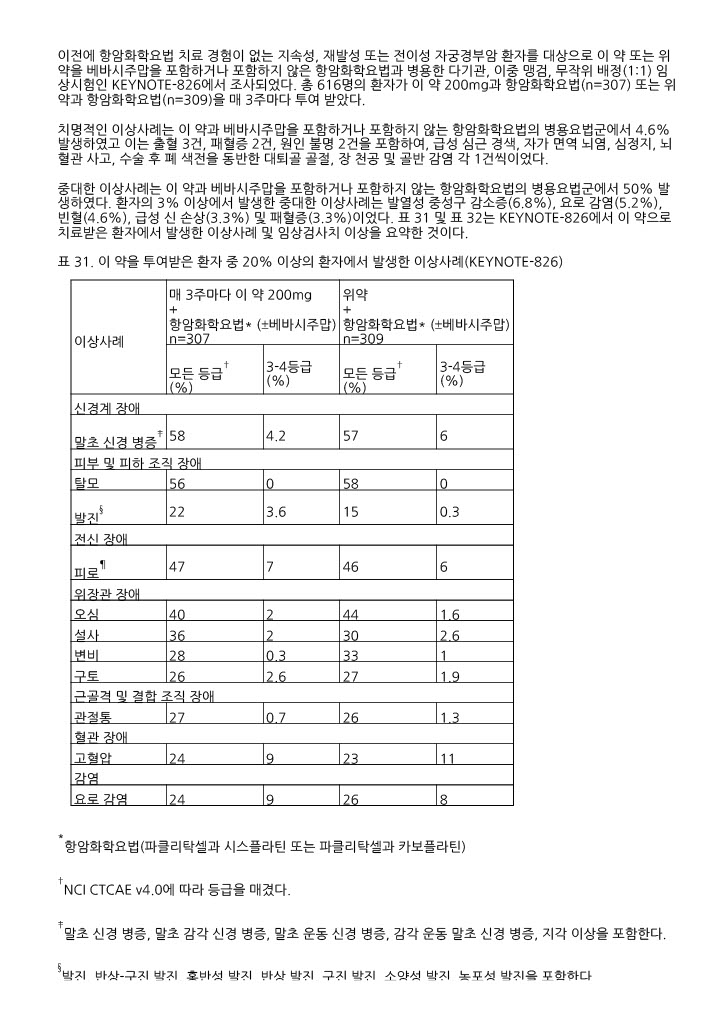
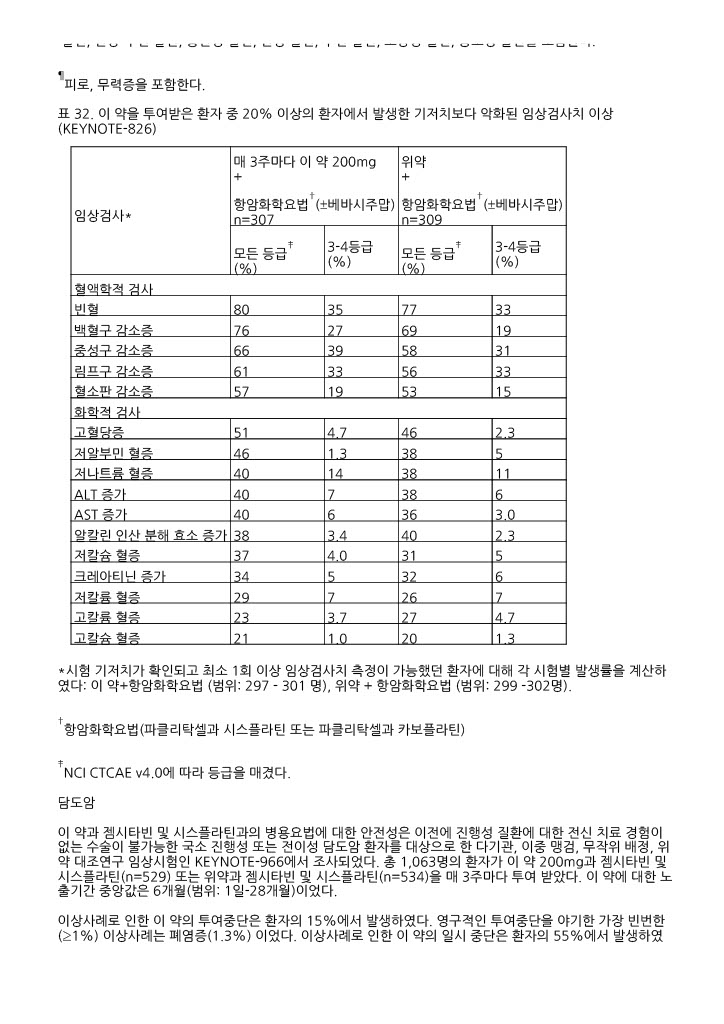
KEYNOTE ‑426: 치료 경험이 없는 진행성 신세포암 환자 대상의 병용 요법 대조 임상시험
엑시티닙과 병용한 이 약의 유효성은 PD ‑L1 종양 상태 및 IMDC(International Metastatic RCC Database Consortium)의 위험 범주와 관계없이 진행성 신세포암 환자를 대상으로 무작위 배정, 다기관, 공개 임상, 활성 대조군 임상시험인 KEYNOTE ‑426에서 평가되었다. 이 임상시험에서는 자가면역질환 환자 또는 면역 억제 치료가 필요한 환자는 제외했다. IMDC기준 위험 범주[저위험(favorable) vs. 중간위험(intermediate) vs. 고위험(poor)] 및 지리적 영역(북미 vs. 서유럽 vs. 기타 국가들)으로 층화되었다. 환자들은 다음 치료군 중 하나에 무작위 배정(1:1)되었다:
▪ 엑시티닙 5 mg 1일 2회 경구투여와 병용하여 이 약 200 mg을 3주마다 정맥 투여한다.
* 엑시티닙의 경우,
‑ 2급 초과하는 치료 관련 부작용이 없으며 혈압이 150/90 mmHg 이하로 잘 조절되는 상태에서 엑시티닙 1일 2회 5 mg을 2회 연속 치료 주기(즉, 6주)동안 용인한 환자들은 1일 2회 7 mg으로 엑시티닙의 용량 증가가 허용되었다.
‑ 동일한 기준을 사용하여 1일 2회 10 mg까지 엑시티닙의 용량 증가가 허용되었다.
‑ 엑시티닙은 독성을 관리하기 위하여 1일 2회 3 mg으로, 이어서 1일 2회 2 mg으로 감량하거나 중단할 수 있다.
▪ 4주 동안 수니티닙 50 mg를 1일 1회 경구투여한 후 2주 동안 투여를 중단한다.
이 약과 엑시티닙을 병용한 치료는 RECIST 1.1에 따른 BICR 평가에 근거한 질병의 진행, 허용 불가능한 독성의 발생, 또는 이 약의 경우, 최대 24개월까지 진행되었다. 연구자에 의해 임상적 이익이 있다고 판단되는 경우 질병 진행 후에도 이 약 및 엑시티닙의 투여는 허용되었다. 종양 상태에 대한 평가는 기준 시점에 시작하여, 무작위 배정 후 12주차에 진행되었으며, 그 후 6주마다 54주까지, 그 후에는 12주마다 수행되었다. 화학 및 혈액학 실험실 검사는 매 주기마다 수행되었다.
KEYNOTE ‑426의 861명의 환자 중(이 약 병용 요법 시험군 432명 및 수니티닙 시험군 429명) 베이스라인 특성은 다음과 같다. 연령 중앙값(median age) 62세(범위: 26~90세), 65세 이상 38%, 남성 73%, 백인 79%, 그리고 동양인 16%이었다; 99.9%는 Karnofsky Performance Score(KPS)가 70% 이상이었고, 환자의 IMDC 기준의 위험도 분포는 31%가 저위험(favorable), 56%가 중간위험(intermediate), 그리고 13%는 고위험(poor)이었다.
1차 유효성 평가지표는 전체생존(OS) 및 무진행생존(PFS, RECIST 1.1에 따른 눈가림된 독립중앙평가(BICR)에 근거)였다. 2차 유효성 평가지표는 RECIST 1.1에 따른 눈가림된 독립중앙평가(BICR)에 근거한 객관적 반응률(ORR) 및 반응지속기간(DoR)이었다. 주요 유효성 결과는 표 59에 요약되어 있다.
표 59. 진행성 신세포암 환자에서 이 약 및 엑시티닙에 대한 반응 (KEYNOTE ‑426)
|
평가 지표a |
이 약 및 엑시티닙 n=432 |
수니티닙 n=429 |
|
전체생존(OS) | ||
|
사건 발생 환자 수 (%) |
193 (45%) |
225 (52%) |
|
중앙값(개월) (95% CI) |
45.7 (43.6, NA) |
40.1 (34.3, 44.2) |
|
위험비(HR)*(95% CI) |
0.73 (0.60, 0.88) | |
|
p-값† |
0.00062 | |
|
무진행생존(PFS) | ||
|
사건 발생 환자 수 (%) |
286 (66%) |
301 (70%) |
|
중앙값(개월) (95% CI) |
15.7 (13.6, 20.2) |
11.1 (8.9, 12.5) |
|
위험비(HR)*(95% CI) |
0.68 (0.58, 0.80) | |
|
p-값† |
<0.00001 | |
|
객관적 반응률(ORR) | ||
|
객관적 반응률(ORR)‡(95% CI) |
60% (56, 65) |
40% (35, 44) |
|
p-값§ |
<0.0001 | |
|
반응지속기간(DoR) | ||
|
중앙값(개월) (범위) |
23.6 (1.4+, 43.4+) |
15.3 (2.3, 42.8+) |
a최종 분석에 기초함
*IMDC 위험군 및 지리적 영역에 의해 층화된 Cox 비례 위험 모형에 기초함
†층화된 로그 순위 테스트(log ‑rank test)에 기초한 명목적 p ‑값
‡완전반응(CR) 또는 부분반응(PR)을 보인 최상의 객관적 반응 환자를 기준으로 함
§IMDC 위험군 및 지리적 영역에 의해 층화된 Miettinen & Nurminen 방법을 기반으로 한 명목적 p ‑값
NA = 가용하지 않음
이 연구는 이 약과 엑시티닙 병용 투여시 수니티닙 대비 OS, PFS 및 ORR에 대한 통계적으로 유의미한 개선을 입증하였다.
그림 31. KEYNOTE ‑426 치료군의 전체생존(OS) Kaplan ‑Meier 곡선 (ITT 집단)
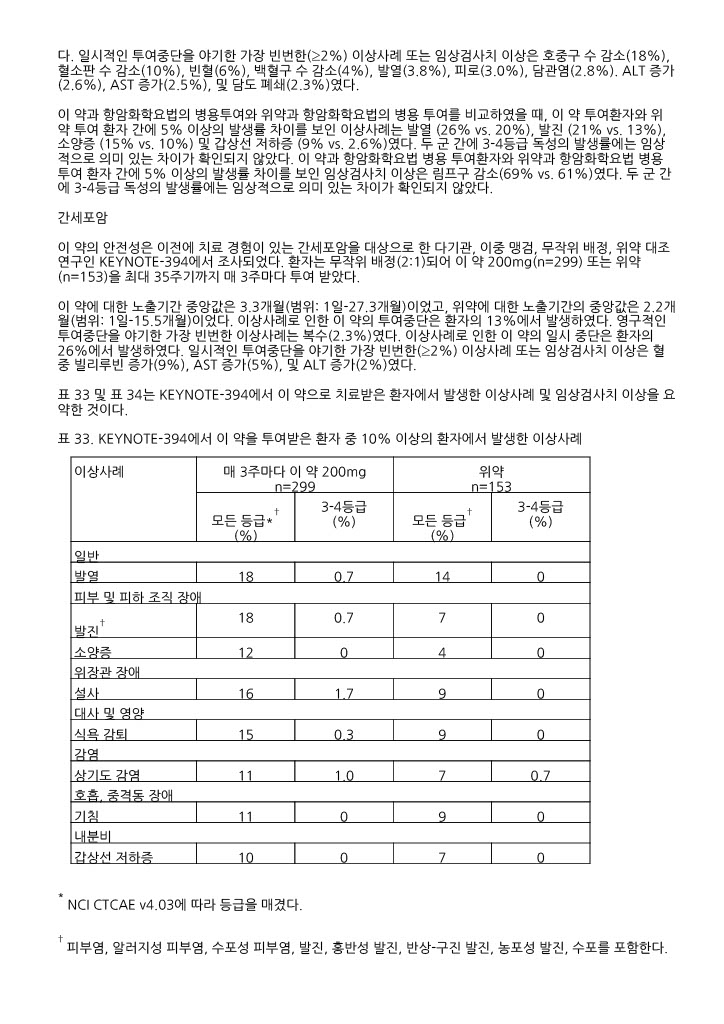

렌바티닙과 병용한 이 약의 유효성은 진행성 신세포암 환자 1,069명을 대상으로 다기관, 공개, 무작위 임상시험인 KEYNOTE ‑581에서 평가되었다. 환자들은 PD ‑L1 종양 발현 상태와 관계없이 등록되었다. 이 임상 시험에서는 활동성 자가면역질환 환자 또는 면역 억제를 필요로 하는 의학적 상태를 가진 환자는 제외되었다. 무작위화는 지리적 영역(북미 vs. 서유럽 vs. 기타 국가들) 및 MSKCC 기준의 위험 범주[저위험(favorable) vs. 중간위험(intermediate) vs. 고위험(poor)]로 층화되었다. 환자들은 다음의 치료군 중 하나에 무작위 배정되었다(1:1:1).
◦ 렌바티닙 20mg 1일 1회 경구투여와 병용하여 이 약 200mg을 3주마다 정맥 투여 한다.
◦ 에베로리무스 5mg 1일 1회 경구투여와 병용하여 렌바티닙 18mg 1일 1회 경구투여한다.
◦ 4주 동안 수니티닙 50mg를 1일 1회 경구투여한 후 2주 동안 휴약한다.
치료는 RECIST 1.1에 따른 BICR 평가에 근거한 질병의 진행이 확인되거나, 허용 불가능한 독성이 발생되기 전까지 계속 진행되었다. 환자가 임상적으로 안정적이고 연구진에 의해 임상적 이익을 얻는 것으로 간주되는 경우, RECIST에 따른 질병 진행 후에도 이 약과 렌바티닙의 투약이 허용되었다.
이 약 치료는 최대 24개월까지 진행되었으며; 렌바티닙 치료의 경우 24개월을 넘어서도 지속할 수 있었다. 종양 상태에 대한 평가는 기저치에서 진행된 이후 8주마다 진행되었다.
KEYNOTE ‑581의 1,069명의 환자 중(이 약과 렌바티닙 병용 요법 시험군 355명, 렌바티닙과 에베로리무스 병용 요법 시험군 357명 및 수니티닙 시험군 357명) 베이스 라인 특성은: 연령 중앙값(median age) 62세(범위: 29 ‑88세); 65세 이상 42%; 남성 75%; 백인 74%, 동양인 21%, 흑인 1%, 그리고 기타 인종 2%였다. Karnofsky Performance Score(KPS)가 70 ‑80%인 환자는 18%, 90 ‑100%인 환자는 82%였다; IMDC 기준의 위험도 분포는 33%가 저위험(favorable), 56%가 중간위험(intermediate), 그리고 10%는 고위험(poor) 이었으며; MSKCC 기준의 위험도 분포는 27%가 저위험(favorable), 64%가 중간위험(intermediate), 그리고 9%는 고위험(poor) 이었다. 환자의 일반적인 전이 부위는 폐(68%), 림프절(45%), 그리고 뼈(25%) 였다.
1차 유효성 평가지표는 RECIST 1.1에 따른 BICR 평가에 근거한 무진행 생존(PFS)이었다. 주요 2차 유효성 평가지표는 전체 생존(OS) 및 객관적 반응률(ORR)을 포함하였다. KEYNOTE ‑581의 주요 유효성 결과는 표 60, 그림 33 및 그림 34에 요약되어 있다.
표 60. 진행성 신세포암에서 이 약 및 렌바티닙에 대한 유효성 결과(KEYNOTE ‑581)
|
평가지표 |
이 약 200mg 매 3주에 1회 + 렌바티닙 n=355 |
수니티닙 n=357 |
|
무진행 생존(PFS) | ||
|
사건발생 환자 수(%) |
160 (45%) |
205 (57%) |
|
중앙값(개월) (95% CI) |
23.9 (20.8, 27.7) |
9.2 (6.0, 11.0) |
|
위험비(HR)* (95% CI) |
0.39 (0.32, 0.49) | |
|
p-값† |
<0.0001 | |
|
전체 생존(OS) | ||
|
사건발생 환자 수(%) |
80 (23%) |
101 (28%) |
|
중앙값(개월) (95% CI) |
NR (33.6, NR) |
NR (NR, NR) |
|
위험비(HR)* (95% CI) |
0.66 (0.49, 0.88) | |
|
p-값† |
0.0049 | |
| 최종 분석에서 확인된 전체 생존(OS) | ||
|
사건발생 환자 수(%) |
149 (42%) | 159 (45%) |
|
중앙값(개월) (95% CI) |
53.7 (48.7, NR) | 54.3 (40.9, NR) |
|
위험비(HR)* (95% CI) |
0.79 (0.63, 0.99) | |
*층화된 Cox 비례 위험 모형에 기초함
†로그 순위 테스트에 기반한 양측(Two ‑sided) p ‑값
NR = not reached
이 연구는 수니티닙 시험군 대비 이 약과 렌바티닙 병용요법 시험군에 무작위 배정된 환자의 PFS 및 OS에서 통계적으로 유의미한 개선을 입증했다.
그림 33. KEYNOTE ‑581 치료군의 무진행 생존(PFS) Kaplan ‑Meier 곡선
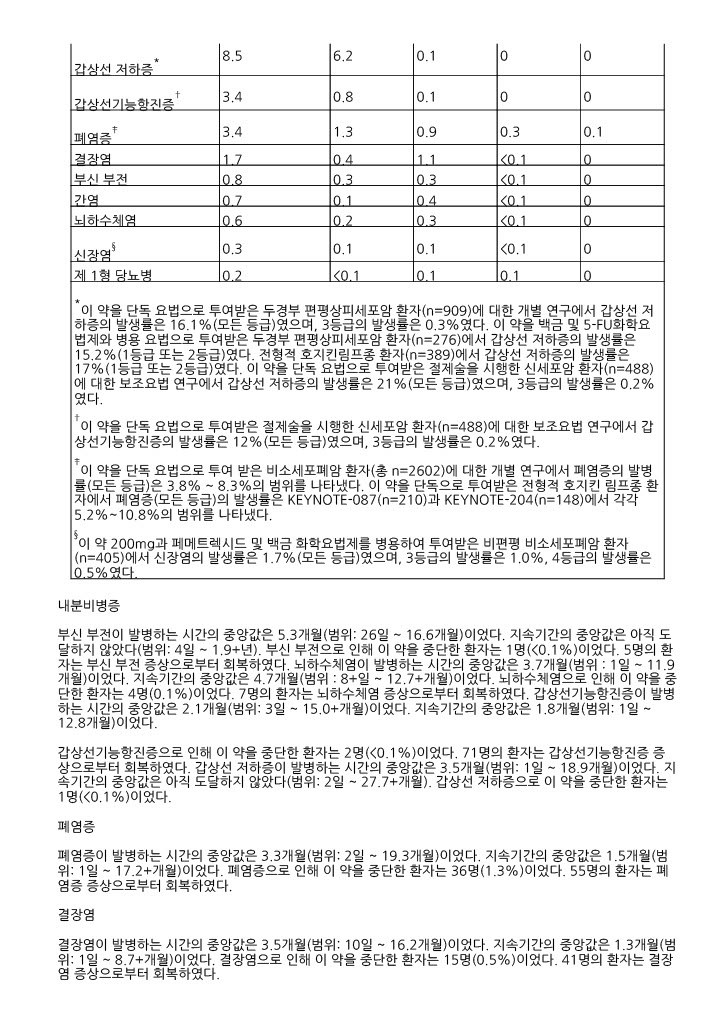
KEYNOTE ‑564: 절제술을 받은 신세포암 환자 대상의 수술 후 보조요법(adjuvant) 치료 위약 대조 임상시험
이 약의 유효성은 신세포암에 대한 보조요법(adjuvant) 치료로서, 신세포암의 재발 위험이 중등 ‑고위험 또는 고위험이거나 M1의 NED(no evidence of disease) 환자 994 명을 대상으로 다기관, 무작위 배정, 이중 맹검, 위약 대조 임상시험인 KEYNOTE ‑564에서 평가되었다. 중등 ‑고위험 및 고위험 범주에는 다음이 포함된다.
◦ 중등 ‑고위험
‑ pT2, 4등급 또는 육종, N0, M0
‑ pT3, 모든 등급, N0, M0
◦ 고위험
‑ pT4, 모든 등급, N0, M0
‑ 모든 pT, 모든 등급, N+, M0
◦ M1 NED (전이병변 완전 절제)
환자는 스크리닝 시점으로부터 4주 이전에 부분 또는 완전 신장 절제술 (M1 NED인 경우 전이성 병변 완전 절제 포함)을 받았어야 하며 수술 절제면이 음성이어야 한다. 활성 자가면역질환 환자 또는 면역 억제 치료가 필요한 환자는 제외했다. 환자는 질병 재발 또는 허용 불가능한 독성이 나타날 때까지 이 약(n=496) 200mg 또는 위약(n=498)을 3주마다 최대 1년까지 투약하도록 무작위 배정(1:1)되었다. 무작위 배정은 전이 상태(M0, M1 NED)에 따라 층화되었고, M0군 내에서는 ECOG PS(0,1) 및 지리적 지역(미국, 미국 외)에 의해 추가로 층화되었다. 환자들은 무작위 배정 이후 처음 2년 동안은 12주마다, 그 다음에는 3년에서 5년까지 16주마다, 그 다음에는 매년 24주마다 영상을 촬영했다.
994명의 환자의 베이스라인 특성은: 연령 중앙값(median age) 60세(범위: 25 ‑84세), 65세 이상 33%; 남성 71%; 그리고 ECOG PS 평가결과 0은 85%, ECOG PS 평가결과 1은 15%이었다.
N0는 94%, 육종이 없는 환자는 84%이었다. 중등 ‑고위험은 86%, 고위험은 8%, M1 NED는 6%이었다.
1차 유효성 평가지표는 임상 시험 연구자가 평가한 무질병 생존(DFS)이고, 주요 2차 평가지표는 OS이다.
표 61. 유효성 결과 (KEYNOTE ‑564)
|
평가 지표 |
이 약 200 mg 3 주마다 n=496 |
위약 n=498 |
|
무질병 생존(DFS) |
|
|
|
사건 발생 환자 수 (%) |
109 (22%) |
151 (30%) |
|
중앙값(개월) (95% CI) |
NR |
NR |
|
위험비(HR)*(95% CI) |
0.68 (0.53, 0.87) | |
|
p-값 |
0.0010† | |
|
24 개월 시점에서의 무질병 생존(DFS) 비율 (95% CI) |
77% (73, 81) |
68% (64, 72) |
|
*층화된 Cox 비례 위험 모형에 기초함 †층화된 로그 순위 테스트(log-rank test)에 기초함 NR = 도달하지 않음 | ||
이 연구는 이 약 투여시 위약 대비 DFS에 대한 통계적으로 유의한 개선을 입증하였다.
그림 35. KEYNOTE ‑564 치료군의 무질병 생존(DFS) Kaplan ‑Meier 곡선
KEYNOTE ‑868/NRG ‑GY018: 새로 진단된 진행성 또는 재발성 자궁내막암 환자 대상의 병용 요법 대조 임상시험
파클리탁셀 및 카보플라틴과 병용한 이 약의 유효성은 진행성 또는 재발성 자궁내막암 환자 810명을 대상으로 한 다기관, 무작위 배정, 이중 맹검, 위약 대조 임상시험인 KEYNOTE ‑868/NRG ‑GY018에서 조사되었다. 임상시험 설계에는 MMR 상태에 따라 구분된 2개의 코호트를 포함하였다; 222명(27%)의 환자들은 dMMR 코호트에 포함되었으며, 588명(73%)의 환자들은 pMMR 코호트에 포함되었다. 본 임상시험에서는 측정가능한 III기, 측정가능한 IVA기, IVB기 또는 재발성 자궁내막암(측정가능한 질환 유무에 관계없이)이 모집되었다. 이전에 전신 요법을 받지 않았거나 이전에 수술 후 보조요법으로 항암화학요법을 받은 환자들이 참여할 수 있었다. 이전에 수술 후 보조 항암화학요법을 받은 환자들은 항암화학요법 투여를 마친 후 적어도 12개월이 지난 경우에만 참여할 수 있었다. 암육종을 포함한 자궁 내막 육종이거나, 활동성 자가면역 질환 또는 면역 억제를 필요로 했던 의학적 상태를 갖는 환자는 제외되었다. 무작위화는 MMR 상태, ECOG PS(0 또는 1 vs. 2) 및 이전의 수술 후 보조 항암화학요법 여부에 따라 층화되었다.
환자들은 다음의 치료군 중 하나에 무작위 배정(1:1)되었다:
◦ 매 3주마다 이 약 200 mg, 파클리탁셀 175 mg/m2 및 카보플라틴 AUC 5 mg/mL/min을 총 6주기 동안 투여, 그리고 이어서 매 6주마다 이 약 400 mg을 최대 14주기 동안 투여
◦ 매 3주마다 위약, 파클리탁셀 175 mg/m2 및 카보플라틴 AUC 5 mg/mL/min을 총 6주기 동안 투여, 그리고 이어서 매 6주마다 위약을 최대 14주기 동안 투여
모든 시험 약물은 각 치료 주기의 1일차에 정맥 점적주입되었다. 치료는 질병 진행, 허용 불가능한 독성 또는 최대 20주기(최대 약 24개월)까지 지속되었다. 6주기 치료를 마친 후 RECIST에 따라 정의된 안정 병변 또는 부분 반응을 보이며 측정가능한 질병을 지닌 환자들은 연구자의 판단에 따라 파클라탁셀과 카보플라틴을 이 약 또는 위약과 병용하여 최대 10주기까지 이어서 투여받을 수 있었다. 종양 상태에 대한 평가는 첫 9개월 동안은 9주마다, 그 이후에는 12주마다 수행되었다. 주요 유효성 결과 지표는 RECIST 1.1에 따라 연구자가 평가한 무진행생존(PFS)이었다. 추가 유효성 평가 지표는 전체생존(OS)이었다.
dMMR 인구 집단의 특성은 다음과 같았다: 연령 중앙값 66세(범위: 37 ‑86세), 65세 이상 연령 55%; 백인 79%, 흑인 9% 및 아시아인 3%; 히스패닉 또는 라틴계 5%; ECOG PS 0 64%, ECOG PS 1 33% 및 ECOG PS 2 3%; 재발성 질환 61% 및 원발성 또는 지속성 질환 39%; 5%는 이전에 수술 후 보조 항암화학요법을 받았으며 43%는 이전에 방사선 치료를 받았다. 조직학적 유형은 자궁 내막양 암종(81%), 선암종 NOS(11%), 장액성 암종(2%) 및 그 외(6%)였다.
pMMR 인구 집단의 특성은 다음과 같았다: 연령 중앙값 66세(범위: 29 ‑94세), 65세 이상 연령 54%; 백인 72%, 흑인 16% 및 아시아인 5%; 히스패닉 또는 라틴계 6%; ECOG PS 0 67%, ECOG PS 1 30% 및 ECOG PS 2 3%; 재발성 질환 56% 및 원발성 또는 지속성 질환 44%; 26%는 이전에 수술 후 보조 항암화학요법을 받았으며 41%는 이전에 방사선 치료를 받았다. 조직학적 유형은 자궁 내막양 암종(52%), 장액성 암종(26%), 선암종 NOS(10%), 투명 세포 암종(7%) 및 그 외(5%)였다.
이 연구는 dMMR 및 pMMR 집단 모두에서 위약과 파클리탁셀 및 카보플라틴 병용 투여군에 비해 이 약과 파클리탁셀 및 카보플라틴 병용 투여군에 무작위 배정된 환자에서 통계적으로 유의미한 PFS 개선을 입증하였다. KEYNOTE ‑868 연구의 MMR 상태에 따른 유효성 결과는 표 62 및 그림 36, 그림 37에 요약되어 있다. PFS 분석 시점에서, OS 결과는 성숙하지 않았으며 dMMR 환자군에서 12%의 사망사건 및 pMMR 환자군에서 17%의 사망사건이 발생하였다.
표 62. 유효성 결과(KEYNOTE ‑868)
|
평가 지표 |
dMMR 집단 |
pMMR 집단 | ||
|
이 약+ 항암화학요법* n=110 |
위약+항암화학요법* n=112 |
이 약+ 항암화학요법 * n=294 |
위약+항암화학요법* n=294 | |
|
무진행생존(PFS) | ||||
|
사건 발생 환자 수(%) |
29 (26%) |
60 (54%) |
95 (32%) |
138 (47%) |
|
중앙값(개월) (95% CI) |
NR (30.7, NR) |
8.3 (6.5, 12.3) |
13.1 (10.6, 19.5) |
8.7 (8.4, 11.0) |
|
위험비(HR)† (95% CI) |
0.34 (0.22, 0.53) |
0.57 (0.44, 0.74) | ||
|
p-값‡ |
<0.0001 |
<0.0001 | ||
* 항암화학요법(파클리탁셀 및 카보플라틴)
† 층화된 Cox 비례 위험 모형에 기초함
‡ 층화된 로그 순위 테스트(log ‑rank test)에 기초함(dMMR의 경우 알파경계값 0.00207, pMMR의 경우 알파경계값 0.00116과 비교)
NR=도달하지 않음
그림 36. KEYNOTE ‑868의 무진행생존(PFS) Kaplan ‑Meier 곡선 (dMMR 집단)
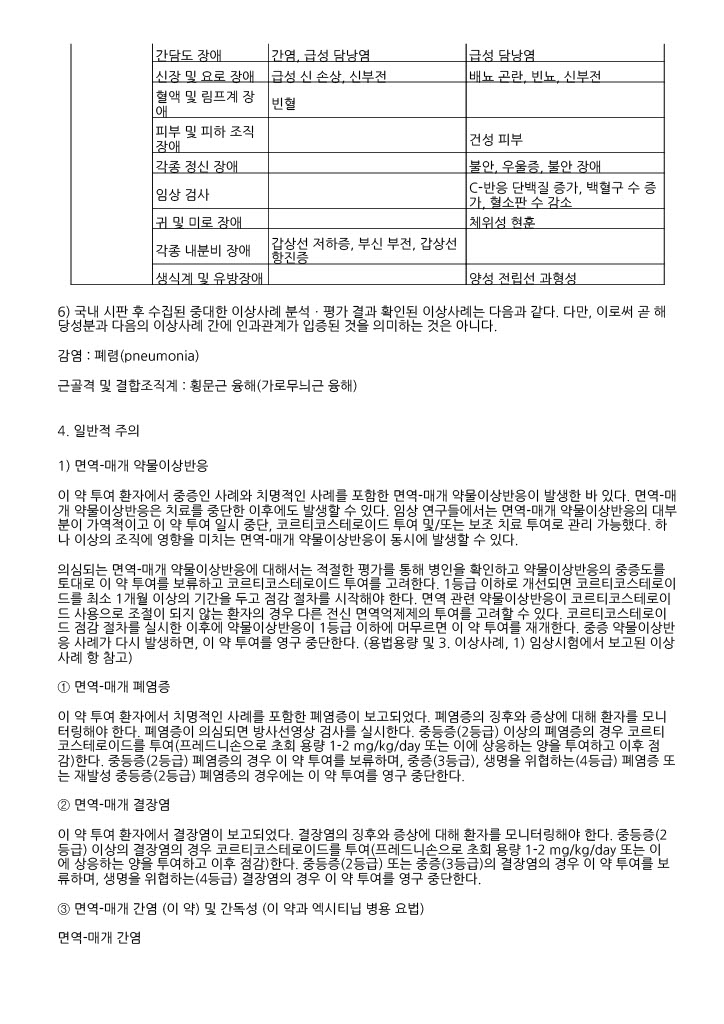
이 약의 유효성은 렌바티닙 병용요법의 다기관, 무작위 배정, 위약 대조, 공개 라벨 임상시험인 KEYNOTE ‑775에서 이전에 수술 전 보조요법(neoadjuvant)과 수술 후 보조요법(adjuvant)을 포함한 모든 요법에서 적어도 하나의 백금기반 화학치료요법으로 투약 경험이 있는 진행성 자궁내막암 827명의 환자에서 조사되었다. 이 임상시험에서는 암 육종을 포함하는 자궁내막 육종이거나 활동성 자가면역 질환 또는 면역 억제를 필요로 하는 의학적 상태를 갖는 환자는 제외되었다. 무작위는 MMR 상태 (dMMR 또는 [dMMR이 없는] pMMR)로 층화되었다. pMMR인 경우에는 ECOG 수행 상태, 지리적 위치, 골반 방사선 치료 이력에 따라 다시 층화되었다. 환자는 다음의 치료군에 무작위 배정(1:1)되었다:
◦ 이 약 200mg을 매 3주마다 정맥 투여하며 렌바티닙 20 mg을 1일 1회 경구 투여와 병용
◦ 연구자의 선택으로 독소루비신 60mg/m2을 매 3주마다 투여하거나, 파클리탁셀 80mg/m2을 매 1주 간격으로 투여하며 3주 투약 후 1주 휴약
이 약과 렌바티닙 병용요법은 RECIST 1.1에 따른 BICR 평가에 근거한 질병의 진행이 확인되거나 전, 허용 불가능한 독성 발생 전까지 투여되었고, 또는 이 약의 경우 최대 24개월까지 투여되었다. 이 약의 투여는 환자가 치료에 내약성을 보이고 연구자가 임상적 이익이 있다고 판단되는 경우 RECIST 1.1로 정의된 질병 진행 후에도 허용되었다. 종양 상태에 대한 평가는 8주마다 수행되었다. 1차 유효성 지표는 전체 생존(OS) 및 RECIST 1.1에 따른 BICR평가에 근거한 무진행생존(PFS)이었다.
총 827명의 환자는 무작위 배정되어, 411명의 환자는 이 약과 렌바티닙 병용요법군 그리고 연구자의 선택에 따라 306명은 독소루비신 또는 110명은 파클리탁셀 투약군에 배정되었다. 이 연구의 인구 집단 특성은 다음과 같았다. 연령 중앙값 65세 (범위: 30 ‑86세), 65세 이상 연령 50%, 백인 61%, 아시아인 21%, 흑인 4%; ECOG PS 0 59%, ECOG PS 1 41% 그리고 84%는 pMMR 종양 상태였다. 조직학적 유형은 자궁내막양암종 60%, 장액성 26%, 투명세포암종 6%, 혼합 5%, 그리고 이 외 3%였다. 모든 827명의 자궁내막암 환자는 이전의 전신 요법으로 치료 경험이 있었다: 1회 69%, 2회 28%, 3회 또는 그 이상의 전신 요법 3%. 37%의 환자는 수술 전 보조요법(neoadjuvant) 또는 수술 후 보조요법(adjuvant) 치료 경험만 있었다.
pMMR인(MSI ‑H 또는 dMMR이 없는) 697명의 유효성 결과는 표 63에 요약되어있다.
표 63. KEYNOTE ‑775의 유효성 결과
|
|
MSI-H 또는 dMMR이 없는 자궁내막암 | |
|
평가 지표 |
매 3주마다 이 약 200mg+렌바티닙 n=346 |
독소루비신 또는 파클리탁셀 n=351 |
|
전체 생존(OS) |
|
|
|
사건 발생 환자 수(%) |
165 (48%) |
203 (58%) |
|
중앙값(개월) (95% CI) |
17.4 (14.2, 19.9) |
12.0 (10.8, 13.3) |
|
위험비(HR)* (95% CI) |
0.68 (0.56, 0.84) | |
|
p-값† |
0.0001 | |
|
무진행 생존(PFS) |
|
|
|
사건 발생 환자 수(%) |
247 (71%) |
238 (68%) |
|
중앙값(개월) (95% CI) |
6.6 (5.6, 7.4) |
3.8 (3.6, 5.0) |
|
위험비(HR)* (95% CI) |
0.60 (0.50, 0.72) | |
|
p-값† |
<0.0001 | |
*Cox회귀모형(Cox regression model)에 기초함
†로그 순위 테스트(log ‑rank test)에 기초함
이 연구는 pMMR인(MSI ‑H 또는 dMMR이 없는) 군에서 이 약과 렌바티닙과의 병용투여시 표준 요법 대비 OS 및 PFS에서 통계적으로 유의미한 개선을 입증하였다.
그림 38. KEYNOTE ‑775에서 pMMR인(MSI ‑H 또는 dMMR이 없는) 자궁내막암 환자의 전체 생존(OS) Kaplan ‑ Meier 곡선 (ITT 집단)

렌바티닙과 병용한 이 약의 유효성은 임의의 환경에서 적어도 하나의 이전의 전신 요법 이후 진행이 확인된 자궁내막암 환자 108명을 대상으로 비무작위, 다기관, 공개 임상, 다중 코호트(multi ‑cohort) 임상시험인 KEYNOTE ‑146에서 평가되었다. 이 임상시험에서는 활성 자가면역질환 환자 또는 면역 억제 치료가 필요한 환자는 제외했다.
환자들은 허용 불가능한 독성 발생 또는 연구진 평가시 질병의 진행이 확인되기 전까지 3주마다 1회 이 약 200 mg 정맥 투여를 렌바티닙 20 mg 1일 1회 경구 투여와 병용하였다. 연구자에 의해 임상적 이익이 있다고 판단되는 경우 질병 진행 후에도 이 약 및 렌바티닙의 투여는 허용되었다. 이 약은 최대 24개월까지 투여되었으며, 렌바티닙은 24개월 이후에도 투여될 수 있었다. 종양 상태에 대한 평가는 기준 시점에 진행된 이후 24주차까지 6주마다, 그 후에는 9주마다 수행되었다. 주요 유효성 평가지표는 RECIST 1.1에 따른 눈가림된 독립중앙평가(BICR)에 근거한 객관적 반응률(ORR) 및 반응지속기간(DoR)이었다.
108명의 환자 중, 87%(n=94)는 MSI ‑H 또는 dMMR을 나타내지 않았으며, 10%(n=11)는 MSI ‑H 또는 dMMR를 나타냈으며, 3%(n=3)에서는 상태를 알 수 없었다. MSI ‑H 또는 dMMR을 나타내지 않는 94명의 환자의 베이스라인 특성은 다음과 같다. 연령 중앙값(median age) 66세, 65세 이상 62%, 백인 86%, 흑인 6%, 동양인 4%, 그리고 기타 인종 3%였다. ECOG PS 0(52%) 또는 1(48%)이었다. 이 환자들 94명 모두 자궁내막암에 대한 이전의 전신 치료를 받았다. 51%는 1가지, 38%는 2가지, 11%는 3가지 이상의 이전의 전신치료를 받았다.
유효성 결과는 표 64에 요약되어있다.
표 64. MSI ‑H 또는 dMMR이 없는 자궁내막암 환자의 유효성 결과
|
평가 지표 |
이 약 및 렌바티닙 n=94* |
|
최상의 객관적 반응† | |
|
객관적 반응률(ORR) % (95% CI) |
38.3% (29, 49) |
|
완전 반응(CR) |
10.6% |
|
부분 반응(PR) |
27.7% |
|
반응지속기간(DoR)† | |
|
중앙값(개월) (범위) |
NR (1.2+, 33.1+)‡ |
|
≥12 개월 반응지속기간(DoR)의 % |
51%§ |
|
반응까지의 시간 | |
|
중앙값(개월) (범위) |
1.4 (1.1, 8.0) |
|
무진행생존(PFS)† | |
|
중앙값(개월) (95% CI) |
5.4 (4.4, 7.6) |
|
전체생존(OS) | |
|
중앙값(개월) (95% CI) |
16.4 (13.5, 25.9) |
*추적 조사 기간의 중앙값 18.7개월
†RECIST 1.1에 따른 BICR 평가에 근거함
‡독립적 검토로 응답한 환자(n=36)에 근거함
§Kaplan ‑Meier 추정 분석에 기초함; 12개월 이상의 반응을 보인 8명의 환자 포함
+진행중임을 나타냄
NR = 도달하지 않음
이 연구는 이 약 및 렌바티닙 병용투여시 ORR 및 DOR에 대한 임상적으로 유의미한 결과를 보였다.
고빈도 ‑현미부수체 불안정성 암 (Microsatellite Instability ‑High Cancer)
KEYNOTE ‑158: 표준요법 이후 진행된 MSI ‑H 또는 dMMR 비직결장암(non ‑Colorectal Cancer, non ‑CRC) 환자 대상의 공개 임상시험
이 약의 유효성은 자궁내막암(n=49), 위암(n=24), 담도암(n=22), 췌장암(n=22), 소장암(n=19) 또는 난소암(n=15) 환자 총 151명을 포함하여 MSI ‑H 또는 dMMR 비직결장암(non ‑CRC) 환자 233명을 대상으로 한 다기관, 비무작위, 공개 임상, 다중 코호트 제 2상 임상시험(KEYNOTE ‑158)에서 평가되었다. 조직학적 소견에 관계없이 MSI 또는 MMR 종양 상태는 각각 중합효소 연쇄반응(PCR) 또는 면역조직화학검사(IHC)에 의해 결정되었다.
환자들은 허용 불가능한 독성 발생이나 질병 진행 전까지 이 약 200 mg을 3주마다 투여 받았다. 질병 진행의 초기 증상을 보인 임상적으로 안정된 환자들은 질병 진행이 확인될 때까지 치료를 유지하도록 허용되었다. 질병 진행이 없는 환자의 경우 최대 24개월까지 치료받을 수 있었다. 이 약을 이용한 치료는 후속적인 질병 진행 시 다시 시작되어 최대 1년까지 추가로 투여될 수 있었다. 종양 상태 평가는 첫 1년은 9주마다, 이후에는 12주마다 수행되었다.
자궁내막암 환자 49명의 베이스라인 특성은: 연령 중앙값(median age) 65세(65세 이상 53%), 백인 90%, 동양인 4%, 흑인 4% 및 ECOG PS 0(49%) 및 1(51%)이었다. 96%가 M1 질환을, 4%가 M0 질환으로 확인되었다. 49%의 환자가 적어도 2가지 이상의 이전의 치료를 받았다. 위암 환자 24명의 베이스라인 특성은: 연령 중앙값(median age) 67세(65세 이상 58%), 남성 63%, 백인 50%, 동양인 46% 및 ECOG PS 0(50%) 및 1(50%)이었다. 모든 환자가 M1 질환으로 확인되었다. 58%의 환자가 적어도 2가지 이상의 이전의 치료를 받았다. 담도암 환자 22명의 베이스라인 특성은: 연령 중앙값(median age) 61세(65세 이상 41%), 남성 73%, 백인 91%, 동양인 9% 및 ECOG PS 0(45%) 및 1(55%)이었다. 82%가 M1 질환으로, 18%가 M0 질환으로 확인되었다. 41%의 환자가 적어도 2가지 이상의 이전의 치료를 받았다. 췌장암 환자 22명의 베이스라인 특성은: 연령 중앙값(median age) 62세(65세 이상 32%), 남성 59%, 백인 82%, 동양인 5% 및 ECOG PS 0(64%) 및 1(36%)이었다. 모든 환자가 M1 질환으로 확인되었다. 77%의 환자가 적어도 2가지 이상의 이전의 치료를 받았다. 소장암 환자 19명의 베이스라인 특성은: 연령 중앙값(median age) 60세(65세 이상 37%), 남성 63%, 백인 84%, 동양인 16% 및 ECOG PS 0(53%) 및 1(47%)이었다. 모든 환자가 M1 질환으로 확인되었다. 37%의 환자가 적어도 2가지 이상의 이전의 치료를 받았다. 난소암 환자 15명의 베이스라인 특성은: 연령 중앙값(median age) 55세(65세 이상 27%), 백인 80%, 동양인 6.7% 및 ECOG PS 0(53%) 및 1(47%)이었다. 모든 환자가 M1 질환으로 확인되었다. 73%의 환자가 적어도 2가지 이상의 이전의 치료를 받았다.
1차 유효성 평가지표는 RECIST 1.1에 따른 눈가림된 독립중앙평가(BICR)에 근거한 객관적반응률(ORR)이었다. 2차 유효성 평가지표는 반응지속기간(DoR), 무진행생존(PFS) 및 전체생존(OS)였다. 추적 관찰 중앙값은 자궁내막암에 대해 24.4개월(범위: 0.5~34.2), 위암에 대해 23.3개월(범위: 1.4~32.6), 담도암에 대해 12.5개월(범위: 1.1~30.9), 췌장암에 대해 4.0개월(범위: 0.4~33.6), 소장암에 대해 20.6개월(범위: 4.2~33.4), 그리고 난소암에 대해 13.1개월(범위: 2.8~24.2)였다. 유효성 결과는 표 65 및 표 66에 요약되어있다.
표 65. MSI ‑H 자궁내막암 또는 난소암 환자의 유효성 결과 (KEYNOTE ‑158)
|
평가 지표 |
자궁내막암 (n=49) |
난소암 (n=15) |
|
객관적 반응률(ORR)* |
| |
|
객관적 반응률(ORR) % (95% CI) |
57% (42.2, 71.2) |
33% (11.8, 61.6) |
|
완전 반응(CR) |
16% |
20% |
|
부분 반응(PR) |
41% |
13% |
|
반응지속기간(DoR)* |
| |
|
중앙값(개월) (범위) |
NR (2.9, 27.0+) |
NR (4.2, 20.7+) |
|
≥24개월 반응지속기간(DoR)의 %† |
74.1% |
NR |
|
반응까지의 시간 |
| |
|
중앙값(개월) (범위) |
2.2 (1.3, 10.6) |
2.0 (1.8, 4.2) |
|
무진행 생존(PFS)* |
| |
|
중앙값(개월) (95% CI) |
25.7 (4.9, NR) |
2.3 (1.9, 6.2) |
|
12개월 시점의 무진행 생존(PFS) 비율 |
58% |
26.7% |
|
24개월 시점의 무진행 생존(PFS) 비율 |
51% |
NR |
|
전체 생존(OS) |
| |
|
중앙값(개월) (95% CI) |
NR (27.2, NR) |
NR (3.8, NR) |
|
12개월 시점의 전체 생존(OS) 비율 |
73.5% |
73.3% |
|
24개월 시점의 전체 생존(OS) 비율 |
69.1% |
64.2% |
*RECIST 1.1에 따른 BICR 평가에 근거함
†Kaplan ‑Meier 추정 분석에 기초함
NR = 도달하지 않음
표 66. MSI ‑H 위암, 담도암, 췌장암 또는 소장암 환자의 유효성 결과 (KEYNOTE ‑158)
|
평가 지표 |
위암 (n=24) |
담도암 (n=22) |
췌장암 (n=22) |
소장암 (n=19) |
|
객관적 반응률(ORR)* |
|
|
| |
|
객관적 반응률(ORR) % (95% CI) |
46% (25.6, 67.2) |
41% (20.7, 63.6) |
18% (5.2, 40.3) |
42% (20.3, 66.5) |
|
완전 반응(CR) |
17% |
9% |
5% |
16% |
|
부분 반응(PR) |
29% |
32% |
14% |
26% |
|
반응지속기간(DoR)* |
|
|
| |
|
중앙값(개월) (범위) |
NR (6.3, 28.4+) |
NR (4.1+, 24.9+) |
13.4 (8.1, 16.0+) |
NR (4.3+, 31.3+) |
|
≥24개월 반응지속기간(DoR)의 %† |
91% |
88% |
NR |
100% |
|
반응까지의 시간 |
|
|
| |
|
중앙값(개월) (범위) |
2.4 (1.9, 4.2) |
2.4 (1.9, 4.2) |
2.1 (1.9, 2.1) |
2.1 (1.9, 4.2) |
|
무진행 생존(PFS)* |
|
|
| |
|
중앙값(개월) (95% CI) |
11.0 (2.1, NR) |
4.2 (2.1, NR) |
2.1 (1.9, 3.4) |
9.2 (2.3, NR) |
|
12개월 시점의 무진행 생존(PFS) 비율 |
48% |
34% |
15.6% |
46% |
|
24개월 시점의 무진행 생존(PFS) 비율 |
44% |
34% |
NR |
46% |
|
전체 생존(OS) |
|
|
| |
|
중앙값(개월) (95% CI) |
NR (7.2, NR) |
24.3 (6.5, NR) |
4.0 (2.1, 9.8) |
NR (10.6, NR) |
|
12개월 시점의 전체 생존(OS) 비율 |
65.2% |
61.9% |
22.7% |
73.7% |
|
24개월 시점의 전체 생존(OS) 비율 |
60.9% |
50.6% |
22.7% |
55.3% |
*RECIST 1.1에 따른 BICR 평가에 근거함
†Kaplan ‑Meier 추정 분석에 기초함
NR = 도달하지 않음
고빈도 ‑현미부수체 불안정성 직결장암 (Microsatellite Instability ‑High Colorectal cancer)
KEYNOTE ‑177: MSI ‑H 또는 dMMR을 나타내는 직결장암 환자 대상에서 1차 치료로서의 대조 임상시험
이 약의 유효성은 치료 경험이 없는 수술이 불가능하거나 전이성인 MSI ‑H 또는 dMMR을 나타내는 직결장암 환자 307명을 대상으로 다기관, 무작위 배정, 공개 임상, 활성 대조군 임상시험인 KEYNOTE ‑177에서 평가되었다. MSI 또는 MMR 종양 상태는 지역에서 사용하는 각 중합효소연쇄반응(PCR) 또는 면역조직화학검사(IHC)에 의해 결정되었다. 자가면역 질환이나 면역 억제를 필요로 하는 의학적 상태를 가진 환자는 임상시험 대상에서 제외되었다.
환자들은 이 약 200mg을 3주마다 정맥투여하거나 연구진의 선택으로 다음의 화학요법제를 2주마다 정맥투여하는 것으로 무작위(1:1) 배정되었다.
◦ mFOLFOX6(옥살리플라틴, 류코보린, 플루오로우라실) 또는 mFOLFOX6을 베바시주맙이나 세툭시맙과 병용: 옥살리플라틴 85 mg/m2, 류코보린 400 mg/m2(또는 레보류코보린 200 mg/m2), 그리고 1일차에 플루오로우라실 400 mg/m2 bolus 투약한 후, 46 ‑48시간에 걸쳐 플루오로우라실 2400 mg/m2을 투약한다. 1일 차에 베바시주맙을 5 mg/kg 투약하거나 첫 주입으로 세툭시맙을 400 mg/m2 투약한 후, 매 1주마다 250 mg/m2을 투약한다.
◦ FOLFIRI (이리노테칸, 류코보린, 플루오로우라실) 또는 FOLFIRI를 베바시주맙이나 세툭시맙과 병용: 이리노테칸 180 mg/m2, 류코보린 400 mg/m2(또는 레보류코보린 200 mg/m2), 그리고 1일차에 플루오로우라실 400 mg/m2 bolus 투약한 후, 46 ‑48시간에 걸쳐 플루오로우라실 2400 mg/m2을 투약한다. 1일 차에 베바시주맙을 5 mg/kg 투약하거나 첫 주입으로 세툭시맙을 400 mg/m2 투약한 후, 매 1주마다 250 mg/m2을 투약한다.
이 약 또는 화학요법제 치료는 연구진의 결정에 따라 RECIST v1.1에 의해 정의된 질병의 진행 또는 허용 불가능한 독성의 발생 전까지 진행되었다. 질병 진행이 없는 환자의 경우 최대 24개월까지 치료받을 수 있었다. 후속 질병 진행 시 이 약을 사용한 치료를 재개하고 최대 1년까지 추가 투여할 수 있었다. 종양 상태 평가는 매 9주마다 수행되었다. 화학요법제 치료에 무작위 배정된 환자에서 질병의 진행이 있는 경우 이 약이 제공되었다. 1차 유효성 지표는 무진행생존(PFS, RECIST v1.1에 따른 BICR평가에 근거) 및 전체생존(OS)였다. 2차 유효성 지표는 반응률(ORR) 및 반응지속기간(DoR)이었다.
총 307명의 환자가 등록되어 이 약(n=153) 또는 화학요법제(n=154) 치료에 무작위 배정되었다. 307명의 베이스라인 특성은 다음과 같다: 연령 중앙값 63세(범위: 24 ‑93세), 65세 이상 47%; 남성 50%; 백인 75% 그리고 동양인 16%; ECOG PS 평가 결과 0은 52%, ECOG PS 평가결과 1인 환자는 48%이었다. 유전자 변이 상태는 BRAF V600E 25%, KRAS/NRAS 24%이었다. 베바시주맙 또는 세툭시맙 병용 여부에 상관없이 화학요법제 치료를 받은 143명의 환자 중, mFOLFOX6를 투약한 환자는 56%였고 FOLFIRI를 투약한 환자는 44%였다.
이 연구의 중간분석에서 화학요법제 투약군에 비해 이 약 치료로 무작위 배정된 환자군에서 통계적으로 유의한 PFS의 개선이 확인되었다. 최종 OS 분석에서는 화학요법제 투약군과 이 약 투약군 간의 통계적으로 유의한 차이가 확인되지는 않았으나, 화학요법제 투약군에 무작위 배정된 환자의 60%에서 이 약을 포함한 항 PD ‑1/PD ‑L1요법 투약을 위해 교차하였다. 최종 분석 시점에서 추적조사기간 중앙값은 38.1개월(범위:0.2 ‑58.7개월)이었다.
표 67. MSI ‑H 직결장암 환자에서의 1차 치료로서 유효성 결과 (KEYNOTE ‑177)
|
평가 지표 |
이 약 200 mg 매 3주에 1회 n=153 |
화학요법제 n=154 |
|
무진행 생존(PFS)* |
|
|
|
사건 발생 환자 수(%) |
82 (54%) |
113 (73%) |
|
중앙값(개월) (95% CI) |
16.5 (5.4, 32.4) |
8.2 (6.1, 10.2) |
|
위험비(HR)*† (95% CI) |
0.60 (0.45, 0.80) | |
|
p-값‡ |
0.0002 | |
|
전체 생존 (OS)§ |
| |
|
사건 발생 환자 수(%) |
62 (41%) |
78 (51%) |
|
중앙값(개월) (95% CI) |
NR (49.2, NR) |
36.7 (27.6, NR) |
|
위험비(HR)† (95% CI) |
0.74 (0.53, 1.03) | |
|
p-값¶ |
0.0359 | |
|
*PFS의 위험비 값은 최종분석에서도 유지되었다. †Cox회귀모형(Cox regression model)에 기초함 ‡로그 순위 테스트(log-rank test)에 기초함(유의수준 0.0117과 비교) §최종 분석결과에 기초함 ¶다중성 조정 후 통계적으로 유의하지 않음 NR=도달하지 않음 | ||
그림 40. KEYNOTE ‑177 치료군의 무진행 생존(PFS) Kaplan ‑Meier 곡선 (ITT 집단)

†다중성 조정 후 통계적으로 유의하지 않음
KEYNOTE ‑164: 이전에 플루오로피리미딘 및 옥살리플라틴 또는 플루오로피리미딘 및 이리노테칸 치료 경험이 있는 MSI ‑H 또는 dMMR 직결장암(Colorectal Cancer, CRC) 환자 대상의 공개 임상시험
이 약의 유효성은 MSI ‑H 또는 dMMR 직결장암(CRC) 환자를 대상으로 한 다기관, 비무작위, 공개 임상, 다중 코호트 제 2상 임상시험(KEYNOTE ‑164)에서 평가되었다. MSI 또는 MMR 종양 상태는 각각 중합효소 연쇄반응(PCR) 또는 면역조직화학검사(IHC)를 사용하여 결정되었다. 유효성은 플루오로피리미딘 및 옥살리플라틴 또는 플루오로피리미딘 및 이리노테칸 치료 이후에도 진행된 진행성 MSI ‑H 또는 dMMR CRC 환자 124명에서 평가되었다[코호트 A(n=61), 코호트 B(n=63)]. 자가 면역 질환 또는 면역 억제를 필요로 하는 의학적 상태를 갖는 환자는 제외되었다.
환자들은 허용 불가능한 독성 발생이나 질병 진행 전까지 이 약 200 mg을 3주마다 투여 받았다. 질병 진행의 초기 증상을 보인 임상적으로 안정된 환자들은 질병 진행이 확인될 때까지 치료를 유지하도록 허용되었다. 질병 진행이 없는 환자의 경우 최대 24개월까지 치료받을 수 있었다. 이 약을 이용한 치료는 후속적인 질병 진행 시 다시 시작되어 최대 1년까지 추가로 투여될 수 있었다. 종양 상태 평가는 9주마다 수행되었다.
코호트 A에 참여한 환자에 대한 베이스라인 특성은: 연령 중앙값(median age) 53세(65세 이상 31%), 남성 59%, 백인 69%, 동양인 31%, 그리고 ECOG PS 0(48%) 및 1(52%)이었다. 모든 환자들은 이전에 치료받은 경험이 있는 전이성 CRC 환자였다. 98%가 MSI ‑H 또는 dMMR 종양을 나타냈으며, 90%가 2가지 이상의 이전의 치료를 받았다. 코호트 B에 참여한 환자에 대한 베이스라인 특성은: 연령 중앙값(median age) 59세(65세 이상 40%), 남성 52%, 백인 67%, 동양인 22%, 그리고 ECOG PS 0(35%) 및 1(65%)이었다. 94%가 M1 질환으로, 6%가 M0 질환으로 확인되었다. 모든 환자가 적어도 1가지의 이전의 치료를 받았으며, 62%는 2가지 이상의 이전의 치료를 받았다.
1차 유효성 평가지표는 RECIST 1.1에 따른 눈가림된 독립중앙평가(BICR)에 근거한 객관적반응률(ORR)이었다. 2차 유효성 평가지표는 반응지속기간(DoR), 무진행생존(PFS) 및 전체생존(OS)였다.
코호트 A에서 61명 및 코호트 B에서 63명 환자에 대한 추적 관찰 기간 중앙값은 각각 31.3개월(범위: 0.2~35.6) 및 24.2개월(범위: 0.1~27.1)이었다. 유효성 결과는 표 68에 요약되어있다.
표 68. MSI ‑H 직결장암 환자의 유효성 결과 (KEYNOTE ‑164)
|
평가 지표 |
코호트 A (n=61) |
코호트 B (n=63) |
|
객관적 반응률(ORR)* |
| |
|
객관적 반응률(ORR) % (95% CI) |
33% (21.3, 46.0) |
33% (22.0, 46.3) |
|
완전 반응(CR) |
3.3% |
7.9% |
|
부분 반응(PR) |
30% |
25% |
|
반응지속기간(DoR)* |
| |
|
중앙값(개월) (범위) |
NR (6.2, 31.3+) |
NR (4.4, 23.6+) |
|
≥18개월 반응지속기간(DoR)의 %† |
95% |
95% |
|
반응까지의 시간 |
| |
|
중앙값(개월) (범위) |
4.3 (1.8, 24.9) |
3.9 (1.8, 12.5) |
|
무진행 생존(PFS)* |
| |
|
중앙값(개월) (95% CI) |
2.3 (2.1, 8.1) |
4.1 (2.1, 18.9) |
|
12개월 시점의 무진행 생존(PFS) 비율 |
34% |
41% |
|
24개월 시점의 무진행 생존(PFS) 비율 |
31% |
37% |
|
전체 생존(OS) |
| |
|
중앙값(개월) (95% CI) |
31.4 (21.4, NR) |
NR (19.2, NR) |
|
12개월 시점의 전체 생존(OS) 비율 |
72% |
76% |
|
24개월 시점의 전체 생존(OS) 비율 |
55% |
63% |
*RECIST 1.1에 따른 BICR 평가에 근거함
†Kaplan ‑Meier 추정 분석에 기초함
NR = 도달하지 않음
삼중음성 유방암(Triple ‑Negative Breast cancer)
KEYNOTE ‑522: 고위험 조기 삼중음성 유방암 환자 대상의 수술 전 보조요법(neoadjuvant) 및 수술 후 보조요법(adjuvant) 대조 임상시험
이 약의 유효성은 수술 전 보조요법으로서 카보플라틴 및 파클리탁셀에 이어 독소루비신 또는 에피루비신 및 사이클로포스파마이드와의 병용 요법 및 수술 후 보조요법으로서 단독 요법의 무작위 배정, 이중 맹검, 다기관, 위약 대조 임상시험인 KEYNOTE ‑522에서 평가되었다. 주요 선정 기준은 PD ‑L1 발현에 관계없이 이전의 치료 경험이 없는 새로 진단된 고위험 조기 삼중음성 유방암(림프절 침범이 있는 경우 종양크기 지름이 >1 cm이면서 지름 ≦2 cm, 또는 림프절 침범에 관계없이 종양크기 지름 >2 cm) 환자였다. 2년 이내 전신 치료가 필요했던 활성 자가면역질환 또는 면역 억제를 필요로 하는 의학적 상태를 가진 환자는 임상시험 대상에서 제외되었다. 무작위배정은 림프절 침범 상태(양성 vs. 음성), 종양 크기(T1/T2 vs. T3/T4), 그리고 카보플라틴 처방(매 3주마다 vs. 매주)에 따라 층화되었다.
◦ 수술 전 보조요법
환자들은 아래 화학요법과 병용하여 이 약 200 mg을 3주마다 8회 또는 위약을 투여받았다.
(1 ‑4주기)
‑ 카보플라틴: 1일차에 매 3주마다 AUC 5 mg/mL/min 또는 1 ‑4주기의 1일, 8일, 15일차에 매주 AUC 1.5 mg/mL/min
‑ 파클리탁셀: 매주 1일, 8일, 15일차에 80 mg/m2
(5 ‑8주기)
‑ 1일차에 매 3주마다 독소루비신 60 mg/m2또는 에피루비신 90 mg/m2
‑ 사이클로포스파마이드: 1일차에 매 3주마다 600 mg/m2
◦ 수술 후 보조요법
‑ 이 약 200 mg 또는 위약을 매 3주마다 총 9주기 동안 투여
이 약 또는 위약을 사용한 치료는 치료 완료(17주기), 근치적 수술을 불가능하게 하는 질병 진행, 수술 후 질병 재발, 또는 허용 불가능한 독성 발생 전까지 지속되었다.
일차 유효성 평가지표는 병리학적 완전반응(pCR) 비율과 무사건생존율(EFS)이었다.
pCR: 유방과 림프절에 침습성 암이 없는 상태(ypT0/Tis ypN0)
총 1174명의 환자가 무작위 배정되어, 784명의 환자는 이 약군 그리고 390명의 환자는 위약군에 배정되었다. 이 연구의 인구 집단 특성은 다음과 같았다: 연령 중앙값 49세(범위: 22 ‑80세), 65세 이상 연령 11%; 여성 99.9%; 백인 64%, 아시아인 20%, 흑인 5%, 아메리칸 인디언 또는 알래스카 원주민 2%; ECOG PS 0 87%, ECOG PS 1 13%; 폐경 전 56%, 폐경 후 44%; 원발성 종양 1 (T1) 7%, T2 68%, T3 19%, T4 7%; 림프절 침범 0 (N0) 49%, N1 40%, N2 11%, N3 0.2%; 종합 병기 II기 환자 75% 및 III기 환자 25%.
유효성 결과는 표 69 및 그림 42에 요약되어 있다.
표 69. 고위험 조기 삼중음성 유방암 환자의 유효성 결과 (KEYNOTE ‑522)
|
평가 지표 |
매 3주마다 이 약 200 mg + 화학요법 / 매 3주마다 이 약 200 mg |
위약 + 화학요법 / 위약 |
|
병리학적 완전반응(pCR (ypT0/Tis ypN0)*) |
n=669 |
n=333 |
|
pCR 비율(%), (95% CI) |
64.0 (60.2, 67.6) |
54.7 (49.1, 60.1) |
|
치료 차이 (%) 추정 (95% CI)† |
9.2 (2.8, 15.6) | |
|
p-값 |
0.00221 | |
|
무사건생존율(EFS)‡ |
n=784 |
n=390 |
|
사건 발생 환자 수(%) |
123 (16%) |
93 (24%) |
|
24개월에서의 EFS 비율 (95% CI) |
87.8 (85.3, 89.9) |
81.0 (76.8, 84.6) |
|
위험비 (95% CI)§ |
0.63 (0.48, 0.82) | |
|
p-값¶ |
0.00031 | |
|
*사전 지정된 pCR 최종 분석에 기초함 (유의수준 0.0028과 비교) †림프절 침범 상태, 종양 크기 및 카보플라틴 처방에 의해 층화된 Miettinen & Nurminen 방법에 기초함 ‡사전 지정된 EFS 중간 분석에 기초함 (유의수준 0.0052와 비교) §치료를 림프절 침범 상태, 종양 크기 및 카보플라틴 처방에 의해 층화된 공변량으로 하는 에프론의 타이 처리 방법(Efron’s method of tie handling)을 이용한 Cox 회귀 모델을 기초로 함 ¶림프절 침범 상태, 종양 크기 및 카보플라틴 처방에 의해 층화된 로그 순위 테스트(log-rank test)에 기초함 | ||
이 연구는 시험군(이 약+항암화학요법/이 약)이 대조군(위약+항암화학요법/위약) 대비 pCR 및 EFS에 대한 통계적으로 유의한 개선을 입증하였다.
그림 42. KEYNOTE ‑522 치료군의 무사건생존율(EFS) Kaplan ‑Meier 곡선 (ITT 집단)

이 약의 유효성은 파클리탁셀, 알부민 결합 파클리탁셀, 또는 젬시타빈과 카보플라틴 병용요법의 다기관, 무작위 배정, 위약 대조 임상시험인 KEYNOTE ‑355에서 조사되었다. 주요 피험자 선정 기준은 PD ‑L1발현에 관계없이 이전의 화학요법 치료 경험이 없는 수술이 불가능한 국소 재발성 또는 전이성 삼중음성 유방암 환자였다. I ‑III기 유방암에 대한 완치목적 치료 완료 6개월 후 국소 또는 원위 질병재발이 있는 환자, (신)보조요법으로 안트라사이클린 전신 치료를 받은 경우이거나 안트라사이클린에 금기인 환자를 등록하였다. 이전 선행요법으로 탁산 제제 젬시타빈 또는 백금 제제를 완치목적으로 투여한 환자의 경우 투여후 12개월 이상인 경우에만 동일계열의 화학요법 투여가 가능했다.
환자는 위약군 또는 이 약군에 무작위 배정(1:2)되었고, 화학요법(파클리탁셀 또는 알부민 결합 파클리탁셀 vs. 젬시타빈과 카보플라틴), PD ‑L1 IHC 22C3 pharmDxTM키트에 따른 종양 PD ‑L1 발현(CPS ≧1 vs. CPS<1), 그리고 수술 전 보조요법(neoadjuvant)치료로 동일한 화학요법 군으로의 이전 치료여부(예 vs.아니오)에 따라 층화되었다.
위약 또는 이 약 200mg을 매 3주 1일차에 투여하며, 다음 세 가지 화학요법 중 하나를 선택하여 병용투여한다.
‑ 알부민 결합 파클리탁셀 100mg/m2을 매 28일 간격으로 1일, 8일, 15일 차에 병용 투여
‑ 파클리탁셀 90mg/m2을 매 28일 간격으로 1일, 8일, 15일 차에 병용 투여
‑ 젬시타빈 1000mg/m2과 카보플라틴 AUC 2mg/mL/min을 매 21일 간격으로 1일, 8일 차에 병용 투여
이 약 또는 위약 치료는 연구자로부터 RECIST 1.1에 따른 질병의 진행이 확인되기 전, 허용 불가능한 독성 발생 전, 또는 최대 24개월까지 계속 진행되었다. 이 약의 투여는 환자가 임상적으로 안정적이고 연구자에 의해 임상적 이익을 도출하는 것으로 간주되는 경우 RECIST가 정의한 질병 진행 후에도 허용되었다. 종양 상태에 대한 평가는 8주, 16주, 24주차에 수행되었으며, 이 후 첫 1년까지는 9주마다, 그리고 이후에는 12주마다 수행되었다.
1차 유효성 지표는 종양 PD ‑L1 발현이 CPS ≧10인 환자에서의 RECIST 1.1에 따른 눈가림된 독립중앙평가(BICR)에 근거한 전체생존(OS) 및 무진행생존(PFS)이었다. 2차 유효성 지표는 반응률(ORR) 및 반응지속기간(DoR)이었다.
총 847명의 환자는 무작위 배정되어, 566명의 환자는 이 약 그리고 281명의 환자는 위약 투여군에 배정되었다. 이 연구의 인구 집단 특성은 다음과 같았다: 연령 중앙값 53세 (범위:22 ‑85세), 65세 이상 연령 21%; 여성 100%; 백인 68%, 아시아인 21%, 흑인 4%; ECOG PS 0 60%, ECOG PS 1 40% 그리고 68%는 폐경 상태였다. 75%의 환자에서 CPS ≧1의 종양 PD ‑L1 발현을, 38%의 환자에서 CPS ≧10의 종양 PD ‑L1발현을 나타냈다.
유효성 결과는 표 70, 그림 43 및 그림 44에 요약되어 있다.
표 70. PD ‑L1 발현 CPS ≧10인 삼중음성 유방암 환자에서의 유효성 결과
|
평가 지표 |
이 약+ 항암화학요법제* n=220 |
위약+ 항암화학요법제* n=103 | |
|
전체생존(OS)† | |||
|
사건 발생 환자 수(%) |
155 (70%) |
84 (82%) | |
|
중앙값(개월) (95% CI) |
23.0 (19.0, 26.3) |
16.1 (12.6, 18.8) | |
|
위험비(HR)‡ (95% CI) |
0.73 (0.55, 0.95) | ||
|
p-값§ |
0.0093 | ||
|
무진행 생존(PFS)¶,# | |||
|
사건 발생 환자 수(%) |
136 (62%) |
79 (77%) | |
|
중앙값(개월) (95% CI) |
9.7 (7.6, 11.3) |
5.6 (5.3, 7.5) | |
|
위험비(HR)‡ (95% CI) |
0.65 (0.49, 0.86) | ||
|
p-값§ |
0.0012 | ||
|
*항암화학요법제: 파클리탁셀, 알부민결합 파클리탁셀, 또는 젬시타빈과 카보플라틴 †사전 지정된 최종 분석에 기초함 ‡연구 내 항암화학요법제(탁산 vs. 젬시타빈과 카보플라틴)와 수술 전 보조요법(neoadjuvant) 치료로서 동일한 화학요법 군으로의 이전 치료여부(예 vs. 아니오)를 치료의 공변량으로 층화한 Efron 분석(Efron’s method of tie handling)의 Cox 회귀 모델에 기초함 §연구 내 항암화학요법제(탁산 vs. 젬시타빈과 카보플라틴)와 수술 전 보조요법(neoadjuvant) 치료로서 동일한 화학요법 군으로의 이전 치료여부(예 vs. 아니오)의 층화된 로그 순위 테스트(log-rank test)에 기초한 단측(one-sided) p-값 ¶ RECIST 1.1에 따른 BICR 평가 #사전 지정된 중간 분석에 기초함 | |||
이 연구는 PD ‑L1 발현 CPS ≧10군에서 화학요법 대조군 대비 이 약과 화학요법 병용한 시험군에서 PFS 및 OS에서 통계적 유의성을 입증하였다. 하위군 분석결과 대부분 일관적인 치료적 유익성을 보였으나, 무질병기간(Disease Free Interval)에 따른 하위군 분석 결과 중 ‘12개월 이내 재발한 종양 PD ‑L1 발현 CPS ≧10인 환자군의 경우’ 이 약과 화학요법제 병용군(n=49)과 위약과 화학요법제(n=17) 병용군의 무진행생존 중앙값은 각각 7.5개월과 7.2개월, 전체생존 중앙값은 각각 17.4개월과 19.7개월을 보였다.
그림 43. KEYNOTE ‑355 치료군의 전체생존(OS) Kaplan ‑Meier 곡선 (CPS ≧10)

KEYNOTE ‑A18: FIGO 2014 III ‑IVA기 자궁경부암 환자 대상의 화학방사선요법과의 병용 요법 대조 임상시험
시스플라틴 및 외부 빔 방사선 요법(EBRT) 후 근접치료(BT)와 병용한 이 약의 유효성은 이전에 자궁경부암 치료를 위해 근치적 수술, 방사선, 또는 전신 요법을 받은 적이 없는 자궁경부암 환자 1060명을 대상으로 한 다기관, 무작위, 이중 맹검, 위약 대조 임상시험인 KEYNOTE ‑A18에서 조사되었다. 림프절 양성 또는 음성 질환을 지닌 FIGO 2014 III ‑IVA기(골반 측벽으로 확장된 종양, 수신증/비기능 신장, 또는 인접 골반 기관으로 퍼진 종양을 지니거나 지니지 않은 질 하부 종양 침범) 환자 596명 및 림프절 양성 질환을 지닌 FIGO 2014 IB2 ‑IIB기(종양 병변 >4 cm 또는 종양이 자궁 너머로 퍼졌지만 골반 벽이나 질 하부 1/3 지점까지는 확장되지 않은 임상적으로 확인 가능한 병변) 환자 462명이 참여하였다; 2명의 환자는 FIGO 2014 IVB기 질환을 가지고 있었다. 무작위배정은 계획된 EBRT의 종류(세기조절 방사선치료[IMRT] 또는 입체적 세기조절 회전치료[VMAT] vs. 비 ‑IMRT 및 비 ‑VMAT), 스크리닝 시점에서의 자궁경부암 병기(FIGO 2014 IB2 ‑IIB기 vs. III ‑IVA기), 그리고 계획된 총 방사선 요법 용량(동등 용량[EQD2]에 따른 [EBRT+BT 용량] <70 Gy vs. ≧70 Gy)에 따라 충화되었다. 환자들은 두 치료군 중 하나에 무작위배정(1:1)되었다:
◦ 시스플라틴 매주 40 mg/m2 정맥투여(5주기, 현지 관행에 따라 선택적으로 6번째 투여 가능) 및 방사선요법(EBRT 후 BT)과 병용하여 이 약 200 mg을 매 3주마다 정맥투여(5 주기), 그리고 이어서 이 약 400 mg을 매 6주마다 정맥투여(15주기)
◦ 시스플라틴 매주 40 mg/m2 정맥투여(5주기, 현지 관행에 따라 선택적으로 6번째 투여 가능) 및 방사선요법(EBRT 후 BT)과 병용하여 위약을 매 3주마다 정맥투여(5 주기), 그리고 이어서 위약을 매 6주마다 정맥투여(15주기)
치료는 RECIST v1.1에 따라 연구자가 평가한 질병 진행이 확인되거나 허용 불가능한 독성 발생 전까지 지속되었다.
종양 상태에 대한 평가는 첫 2년 동안은 화학방사선요법을 마친 뒤 매 12주마다, 3년차에는 매 24주마다, 그 이후에는 매해 수행되었다. 주요 유효성 평가지표는 최대 10개의 표적 병변과 장기당 최대 5개의 표적 병변을 따르도록 수정된 RECIST v1.1 또는 조직병리학적 확인에 따라 연구자가 평가한 무진행 생존(PFS) 및 전체 생존(OS)이었다.
FIGO 2014 III ‑IVA기 질환을 지닌 596명의 환자들의 베이스라인 특성은 다음과 같다: 연령 중앙값 52세(범위: 22 ‑87세), 65세 이상 연령 17%; 백인 36%, 아시아인 34%, 흑인 1%, 히스패닉 또는 라틴계 38%; ECOG PS 0 68%, ECOG PS 1 32%; CPS ≧1 93%; 골반 양성 및/또는 대동맥 ‑주위 림프절(들) 양성 70%, 골반 또는 대동맥 ‑주위 림프절 모두 음성 30%; 83%는 편평세포암, 17%는 비 ‑편평 조직학을 나타냈다. 방사선의 경우, 85%의 환자가 IMRT 또는 VMAT EBRT를 조사받았으며, EQD2 용량 중앙값은 87 Gy(범위: 7 ‑114)이었다.
이 연구는 전체 모집단에서 PFS에 대한 통계적으로 유의한 개선을 입증하였다. FIGO 2014 IB2 ‑IIB기 질환을 지닌 462명의 환자(44%)에 대한 탐색적 하위군 분석에서, PFS 위험비(HR) 추정값은 0.91(95% CI: 0.63, 1.31)이었으며, 이는 전체 모집단에서의 PFS 개선이 주로 FIGO 2014 III ‑IVA기 질환을 지닌 환자의 하위군에서 나타난 결과로 설명될 수 있음을 나타낸다. OS 결과는 PFS 분석 시점에서 성숙하지 않았으며, 전체 모집단의 10%에서 사망 사건이 발생하였다.
FIGO 2014 III ‑IVA기 질환을 지닌 596명의 FIGO 2014 III ‑IVA기 환자에 대한 탐색적 하위군 분석 유효성 결과는 표 71 및 그림 45에 요약되어있다.
표 71. KEYNOTE ‑A18의 유효성 결과(FIGO 2014 III ‑IVA기 자궁경부암 환자)
|
평가지표 |
CRT와 이 약 매 3주마다 200 mg 병용 및 이 약 매 6주마다 400 mg n=293 |
CRT와 위약 병용
n=303 |
|
연구자에 의한 무진행 생존(PFS) | ||
|
사건 발생 환자 수(%) |
61 (21%) |
94 (31%) |
|
중앙값(개월) (95% CI) |
NR (NR, NR) |
NR (18.8, NR) |
|
12개월 시점의 PFS 비율 (95% CI) |
81% (75, 85) |
70% (64, 76) |
|
위험비(HR)* (95% CI) |
0.59 (0.43, 0.82) | |
* 층화되지 않은 Cox 비례 위험 모형에 기초함
CRT = 화학방사선요법
NR = 도달하지 않음
그림 45. KEYNOTE ‑A18의 무진행 생존(PFS) Kaplan ‑Meier 곡선(FIGO 2014 III ‑IVA기 자궁경부암 환자)
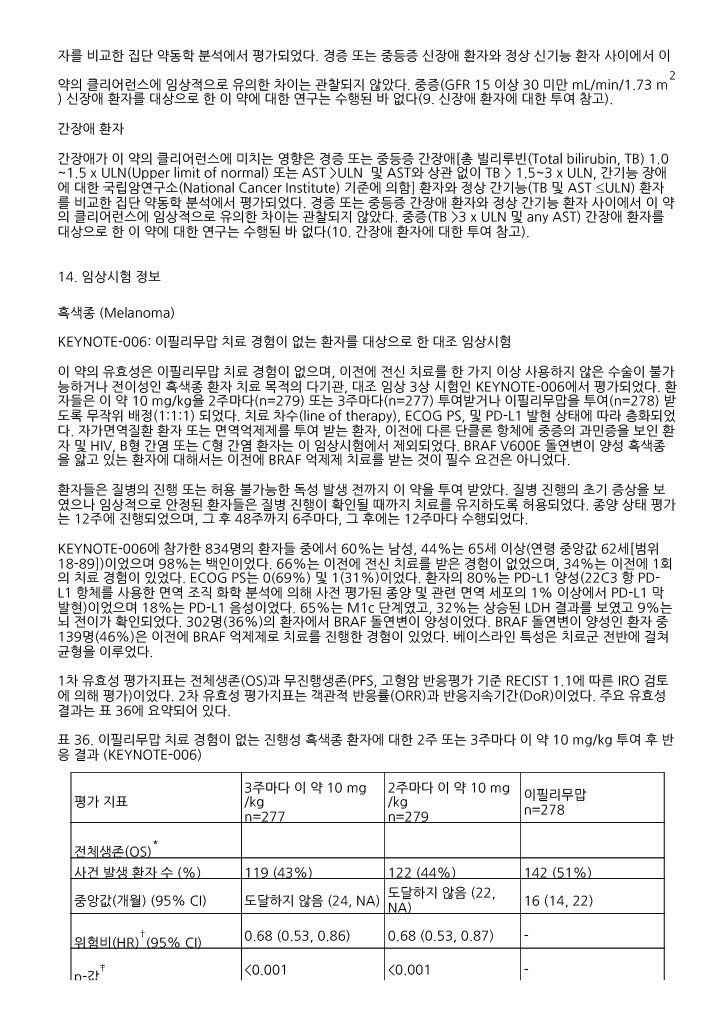
방사선 감광제로 사용된 경험을 제외하고 이전에 항암화학요법 치료 경험이 없는 지속성, 재발성 또는 전이성 자궁경부암 환자 617명을 대상으로 베바시주맙을 포함하거나 포함하지 않는 파클리탁셀과 시스플라틴 또는 파클리탁셀과 카보플라틴과의 병용요법으로 한 다기관, 무작위 배정, 이중 맹검, 위약 대조 임상시험인 KEYNOTE ‑826에서 조사되었다. 환자는 PD ‑L1 발현 상태와 관계없이 등록되었다. 지난 2년 이내 전신 치료가 필요했던 자가면역질환 환자 또는 면역 억제를 필요로 하는 의학적 상태를 가진 환자는 제외되었다. 초기 진단시점에서 전이 상태, 베바시주맙 포함 여부, 종양 PD ‑L1 발현(CPS<1 vs. CPS 1에서 <10 vs. CPS ≧10)에 따라 층화되었다. 환자들은 다음 네가지 항암화학요법 중 연구자가 선택한 항암화학요법과 이 약 200mg 또는 위약 두 군 중 하나에 무작위 배정(1:1)되었다.
‑ 파클리탁셀 175mg/m2 + 시스플라틴 50mg/m2
‑ 파클리탁셀 175mg/m2 + 시스플라틴 50mg/m2 + 베바시주맙 15mg/kg
‑ 파클리탁셀 175mg/m2 + 카보플라틴 AUC 5mg/mL/min
‑ 파클리탁셀 175mg/m2 + 카보플라틴 AUC 5mg/mL/min + 베바시주맙 15mg/kg
모든 연구 치료는 각 3주 치료 주기 중 1일차에 투여되었다. 시스플라틴은 각 3주 치료 주기 중 2일차에 투여가 가능했다. 파클리탁셀과 백금 화학요법은 최대 6주기까지 투여가 가능하였으며 연구자에 의해 6주기 이상 투여하는 것이 허용되었다. 이 약의 치료는 RECIST 1.1에 따른 질병의 진행이 확인되기 전, 허용 불가능한 독성 발생 전, 또는 최대 24개월까지 계속 진행되었다. 이 약의 투여는 환자가 임상적으로 안정적이고 연구자에 의해 임상적 이익이 있다고 판단되는 경우 RECIST가 정의한 질병 진행 후에도 허용되었다. 종양 상태에 대한 평가는 9주차에 수행되었으며, 이 후 첫 1년까지는 9주마다, 그리고 이후에는 12주마다 수행되었다. 1차 유효성 평가지표는 전체 생존(OS) 및 RECIST 1.1에 따라 연구자에 의해 평가된 무진행 생존(PFS)였다.
이 연구의 인구 집단 특성은 다음과 같았다: 연령 중앙값 51세 (범위:22 ‑82세), 65세 이상 연령 16%; 백인 58%, 아시아인 18%, 흑인 1%, 히스패닉 또는 라틴계 37%; ECOG PS 0 56%, ECOG PS 1 43%; 89%의 환자에서 CPS ≧1의 종양 PD ‑L1 발현; 63%의 환자가 베바시주맙 치료를 받음; 선암 23%, 선편평상피세포암 5%; 원격 전이와 관계없이 지속성 또는 재발성 질환의 환자 중 이전에 항암 방사선 치료만을 받은 환자는 39%, 항암방사선 치료와 수술을 받은 환자는 17%였다.
유효성 결과는 표 72, 그림 46 및 그림 47에 요약되어 있다.
표 72. KEYNOTE ‑826에서 CPS 1이상인 군의 유효성 지표
|
평가지표 |
매 3주마다 이 약 200mg + 항암화학요법* (±베바시주맙) n=273 |
위약 + 항암화학요법* (±베바시주맙) n=275 |
|
전체 생존(OS) | ||
|
사건 발생 환자 수 (%) |
118 (43.2) |
154 (56) |
|
중앙값(개월) (95% CI) |
NR (19.8, NR) |
16.3 (14.5, 19.4) |
|
위험비(HR)†(95% CI) |
0.64 (0.50, 0.81) | |
|
p-값‡ |
0.0001 | |
| 최종 분석에서 확인된 전체 생존(OS) | ||
|
사건 발생 환자 수 (%) |
153 (56.0) | 201 (73.1) |
|
중앙값(개월) (95% CI) |
28.6 (22.1, 38.0) | 16.5 (14.5, 20.0) |
|
위험비(HR)†(95% CI) |
0.60 (0.49, 0.74) | |
|
무진행 생존(PFS) | ||
|
사건 발생 환자 수 (%) |
157 (57.5) |
198 (72.0) |
|
중앙값(개월) (95% CI) |
10.4 (9.7, 12.3) |
8.2 (6.3, 8.5) |
|
위험비(HR)†(95% CI) |
0.62 (0.50, 0.77) | |
|
p-값§ |
<0.0001 | |
*항암화학요법 (파클리탁셀과 시스플라틴 또는 파클리탁셀과 카보플라틴)
†Cox 비례위험모형(Cox proportional hazard model)에 기초함
‡층화된 로그 순위 테스트(log ‑rank test)에 기초함 (알파경계값 0.00549와 비교됨)
§층화된 로그 순위 테스트(log ‑rank test)에 기초함 (알파경계값 0.00144와 비교됨)
NR = not reached
이 연구는 이 약 200mg을 3주마다 투여시 위약 대비 OS 및 PFS에 대한 통계적으로 유의한 개선을 입증하였다.
그림 46. KEYNOTE ‑826에서 CPS 1이상인 군의 전체 생존(OS) Kaplan ‑Meier 곡선*,†
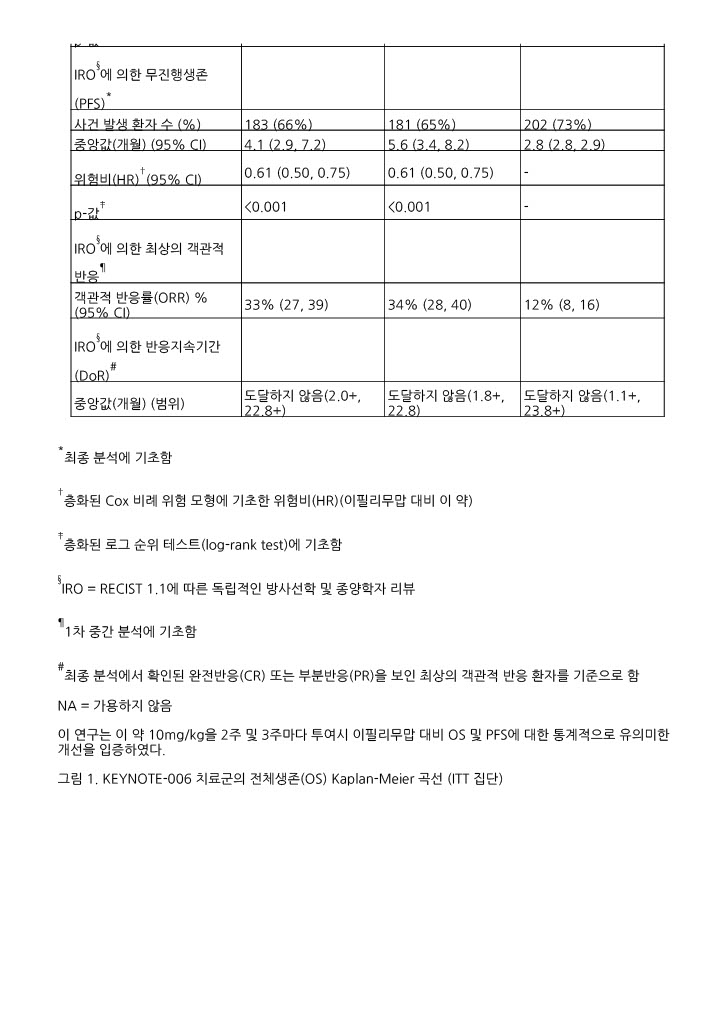
†사전 지정된 최종 분석에 기초함
담도암(Biliary Tract Carcinoma)
KEYNOTE ‑966: 수술이 불가능한 국소 진행성 또는 전이성 담도암 환자 대상의 병용 요법 대조 임상시험
이 약과 젬시타빈 및 시스플라틴 병용 요법의 유효성은 이전에 진행성 질환에 대한 전신 치료를 받은 경험이 없는 수술이 불가능한 국소 진행성 또는 전이성 담도암 환자 1069명을 대상으로 한 다기관, 무작위 배정, 이중 눈가림, 위약 대조 연구인 KEYNOTE ‑966에서 평가되었다. 지난 2년 이내 전신 치료가 필요했던 자가면역질환 환자 또는 면역 억제 치료를 필요로 하는 의학적 상태를 가진 환자는 제외되었다. 무작위 배정은 지역(아시아 vs. 비 ‑아시아), 국소 진행성 vs. 전이성, 원발암 위치(담낭, 간내 또는 간외 담관암)으로 층화되었다.
환자들은 다음의 두 군 중 하나로 무작위 배정(1:1)되었다.
◦ 매 3주마다 1일차에 이 약 200mg 투여 및 젬시타빈 1000mg/m2 + 시스플라틴 25mg/m2 를 1일차, 8일차에 투여
◦ 매 3주마다 1일차에 위약 투여 및 젬시타빈 1000mg/m2 + 시스플라틴 25mg/m2 를 1일차, 8일차에 투여
모든 연구 약물은 정맥 주입으로 투여되었다. 치료는 허용 불가능한 독성이 발생하거나 질병진행이 확인되기 전까지 지속되었다. 이 약의 경우, 치료는 최대 35주기 또는 약 24개월까지 지속되었다. 시스플라틴의 경우, 치료는 최대 8주기까지 투여 가능하였고, 젬시타빈의 경우, 8주기 이상으로 투여 지속이 가능했다.
이 약과 항암화학요법의 병용 투여는 환자가 임상적으로 안정적이고 연구자에 의해 임상적 이익이 있다고 판단되는 경우 RECIST가 정의한 질병 진행 후에도 허용되었다. 종양 상태에 대한 평가는 베이스라인에서 수행되었고, 첫 54주까지는 6주마다, 이후에는 12주마다 수행되었다.
이 연구의 인구 집단 특성은 다음과 같았다: 연령 중앙값 64세 (범위:23 ‑85세), 65세 이상 연령 47%; 남성 52%; 백인 49%, 아시아인 46%, ECOG PS 0 46%, ECOG PS 1 54%; 31%의 환자에서 HBV 감염 이력; 3%의 환자에서 HCV 감염 이력.
1차 유효성 평가지표는 전체 생존(OS)이었고 2차 유효성 평가지표는 RECIST 1.1에 따른 눈가림된 독립중앙평가(BICR)에 의해 평가된 무진행 생존(PFS), 객관적 반응률(ORR) 및 반응지속기간(DOR)이었다.
유효성 결과는 표 73, 그림 48 및 그림 49에 요약되어 있다.
표 73. KEYNOTE ‑966의 유효성 결과
|
평가지표 |
매 3주마다 이 약 200mg와 젬시타빈/시스플라틴 n=533 |
위약과 젬시타빈/시스플라틴 n=536 |
|
전체생존(OS)* | ||
|
사건 발생 환자 수(%) |
414 (78%) |
443 (83%) |
|
중앙값(개월) (95% CI) |
12.7 (11.5, 13.6) |
10.9 (9.9, 11.6) |
|
위험비(HR)†(95% CI) |
0.83 (0.72, 0.95) | |
|
p-값‡ |
0.0034 | |
|
무진행생존(PFS)§ | ||
|
사건 발생 환자 수(%) |
361 (68%) |
391 (73%) |
|
중앙값(개월)* (95% CI) |
6.5 (5.7, 6.9) |
5.6 (5.1, 6.6) |
|
위험비(HR)† (95% CI) |
0.86 (0.75, 1.00) | |
|
p-값‡ |
0.0225 | |
|
객관적 반응률(ORR)§ | ||
|
객관적 반응률¶(95% CI) |
28.7% (24.9, 32.8) |
28.5% (24.8, 32.6) |
|
완전 반응(%) |
11 (2.1%) |
7 (1.3%) |
|
부분 반응(%) |
142 (26.6%) |
146 (27.2%) |
|
p-값# |
0.4735 | |
|
반응지속기간*, Þ |
n=156 |
n=152 |
|
중앙값(개월) (범위) |
8.3 (1.2+, 33.0+) |
6.8 (1.1+, 30.0+) |
* 사전 지정된 최종 OS 분석 결과
† 층화된 Cox 비례 위험 모형(Cox proportional hazard model)에 기초함
‡ 층화된 로그 순위 테스트(log ‑rank test)에 기초한 단측(one ‑sided) p ‑값
§ 사전 지정된 중간 분석 결과
¶ 완전 반응 또는 부분 반응으로 확인됨
# 층화된 Miettinen & Nurminen 방법에 기초한 단측(one ‑sided) p ‑값
Þ Kaplan ‑Meier 추정 분석에 기초함
그림 48. KEYNOTE ‑966에서 치료군의 전체생존(OS) Kaplan ‑Meier 곡선*
간세포암(Hepatocellular Carcinoma)
KEYNOTE ‑394: 이전에 PD ‑1/PD ‑L1 요법을 제외한 전신 요법으로 치료받은 B형 간염 관련 간세포암 환자 대상 대조 임상시험
이 약의 유효성은 이전에 소라페닙 또는 옥살리플라틴 기반 항암화학요법 치료 경험이 있는 국소 치료를 받을 수 없거나 불응성인 Barcelona Clinic Liver Cancer(BCLC) B 또는 C등급의 아시아인 간세포암 환자를 대상으로 한 다기관, 무작위 배정, 위약 대조, 이중 맹검 연구인 KEYNOTE ‑394에서 평가되었다. 환자들은 Child ‑Pugh A 등급의 간기능이 요구되었다. B형간염 환자의 경우 질병이 조절 가능할 정도로 치료되었다(HBV viral load < 2000 IU/mL 또는 < 104 copies/mL). 2년 이내 전신 치료가 필요했던 활성 자가면역질환 또는 면역 억제를 필요로 하는 의학적 상태를 가진 환자는 임상시험 대상에서 제외되었다. 또한 간성 뇌 병증, 문맥 주요분지 침범, 임상적으로 명백한 복수, 또는 최근 6개월 내 식도 또는 위정맥 출혈이 있는 환자도 제외되었다.
무작위 배정은 이전 치료방법: 소라페닙 vs. 옥살리플라틴 기반 항암화학요법, 대혈관 침범 여부, 병인(활성 HBV vs. 기타(활성 HCV, 비감염성))에 의해 층화되었다. 환자들은 이 약 200mg을 3주마다 정맥투여하거나 위약을 투여하는 것으로 무작위(2:1) 배정되었다. 이 약의 치료는 RECIST 1.1에 따른 BICR 평가에 근거한 질병의 진행이 확인되기 전, 허용 불가능한 독성 발생 전, 또는 최대 24개월까지 지속되었다. 종양 상태에 대한 평가는 매 6주마다 수행되었다. 주요 유효성 결과 측정지표는 전체생존(OS)이었다. 추가적인 유효성 결과 측정지표는 RECIST 1.1에 따른 눈가림된 독립중앙평가(BICR)에 의해 평가된 무진행 생존(PFS), 반응률(ORR) 및 반응지속기간(DoR)으로, 이는 총 10개의 대상 병변 및 단일 장기당 최대 5개의 대상 병변에서 평가하도록 수정되었다.
연구에 등록된 환자는 453명이었고, 이 중 360명(79%)이 활성 B형 간염으로 확인되었다. 활성 B형 간염 환자군에 대한 인구 집단 특성은 다음과 같았다: 연령 중앙값 52세 (범위:23 ‑82세), 65세 이상 연령 16%; 남성 86%; 아시아인 100%; ECOG PS 0 42%, ECOG PS 1 58%; 이전에 소라페닙 치료 경험이 있는 경우 90%, 이전에 옥살리플라틴 기반 항암 화학요법 치료 경험이 있는 경우는 10% 였다. 간외질환(extrahepatic disease) 77%; 대혈관 침윤 10%, BCLC 병기 C 93% 및 B 7%, AFP 기저값 ≧ 200ng/mL 57%였다.
KEYNOTE ‑394연구는 B형 간염 관련 간세포암 환자에서 위약 대비 이 약의 OS 개선을 입증했다. 유효성 결과는 표 74 및 그림 50에 요약되어 있다.
표 74. KEYNOTE ‑394의 유효성 결과
|
평가지표 |
매 3주마다 이 약 200mg n=236 |
위약 n=124 |
|
전체 생존(OS)* | ||
|
사건 발생 환자 수 (%) |
172 (73) |
105 (85) |
|
중앙값(개월) (95% CI) |
13.9 (12.5, 17.9) |
13.0 (10.1, 15.6) |
|
위험비(HR)† (95% CI) |
0.78 (0.61, 0.99) | |
|
무진행 생존(PFS) ‡ | ||
|
사건 발생 환자 수 (%) |
189 (80) |
108 (87) |
|
중앙값(개월) (95% CI) |
2 (1.4, 2.7) |
2.3 (1.4, 2.8) |
|
위험비(HR)† (95% CI) |
0.78 (0.61, 1.00) | |
|
객관적 반응률(ORR) ‡ |
| |
|
객관적 반응률§ (95% CI) |
11% (7, 16) |
1.6% (0.2, 5.7) |
|
완전 반응(%) |
2 (0.9) |
1 (0.8%) |
|
부분 반응(%) |
24 (10) |
1 (0.8%) |
|
반응지속기간* |
n=28 |
n=2 |
|
중앙값¶ (개월) (범위) |
23.9 (2.6+, 44.4+) |
5.6 (3.0+, 5.6) |
* 사전 지정된 최종 OS 분석 결과
† 층화된 Cox 비례위험모형(Cox proportional hazard model)에 기초함
‡ 사전 지정된 중간 분석 결과
§ 완전 반응 또는 부분 반응으로 확인됨
¶ Kaplan ‑Meier 추정 분석에 기초함
+ 지속적인 반응을 나타냄
그림 50. KEYNOTE ‑394에서 치료군의 전체생존(OS) Kaplan ‑Meier 곡선


